Zadania buble
Prezentowane w tej sekcji zadania są zadaniami opartymi na błędnych założeniach i wprowadzają w błąd lub ich rozwiązanie jest błędne. Takie zadania nie powinny trafiać do uczniów/studentów, czy nauczycieli chemii, bo nie służą budowaniu świadomości chemicznej, tylko utwierdzają w błędnym myśleniu.
Przeanalizujmy to zadanie:
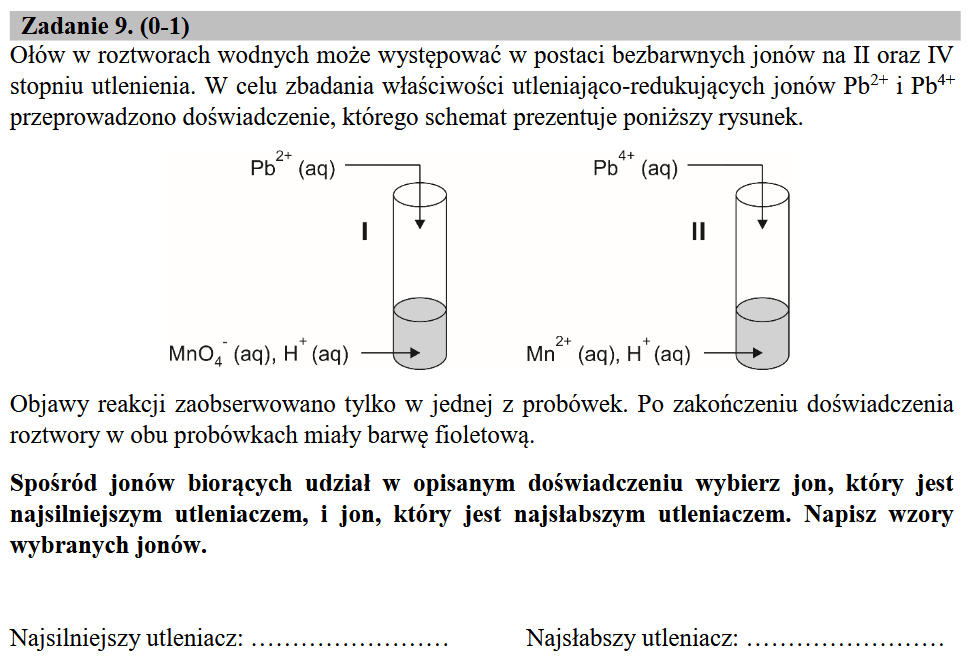
Podobny przypadek zdarza się w zbiorach zadań. Ołów rzeczywiście tworzy związki, w których przypisuje się mu stopnie utlenienia II i IV. Czy jednak możliwe jest użycie wodnego roztworu soli ołowiu(IV), a więc roztworu zawierającego kationy Pb4+? Z pierwszego zdania wynika, że tak. Ale proste kationy o takim ładunku to rzadkość. O ile znane są wszystkie halogenki ołowiu(II): PbF2, PbCl2, PbBr2, i klasyczny złotożółty PbI2, o tyle w przypadku ołowiu(IV) znane są tylko dwa: PbF4 i PbCl4. Tetrafluorek o dużym udziale jonowego charakteru jest jedynym trwałym w temperaturze pokojowej halogenkiem ołowiu. Natomiast kowalencyjny PbCl4 jest cieczą w temperaturze pokojowej (temp. topnienia -15 °C). Rozkłada się nawet w temp. pokojowej na chlor i PbCl2:
PbCl4 → PbCl2 + Cl2
A ogrzany - wybucha.
Halogenki Pb(IV) mają jedną wspólną cechę: nie istnieją w wodnych roztworach. Wprowadzone do wody nieodwracalnie hydrolizują z utworzeniem PbO2:
PbF4 + 2H2O → PbO2 + 4HF
PbCl4 + 2H2O → PbO2 + 4HCl
ponadto w tym drugim przypadku powoli uwalnia się chlor, wskutek następczej reakcji:
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
Wykonanie więc doświadczenia w wersji przedstawionej w zadaniu jest w praktyce niemożliwe, bo nie można otrzymać Pb4+(aq).
Ale spójrzmy na tablice standardowych potencjałów redukcji zaczerpniętych z "Poradnika fizykochemicznego" (WNT, 1974):
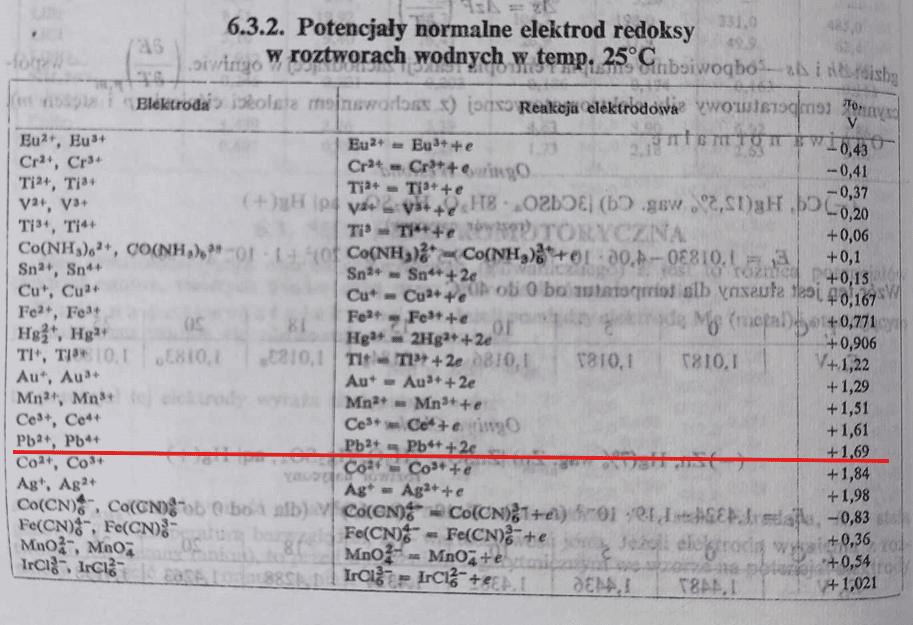
A teraz popatrzmy na nowe karty wzorów CKE. Brak w nich standardowego potencjału redukcji półogniwa Pb4+ + 2e → Pb2+.
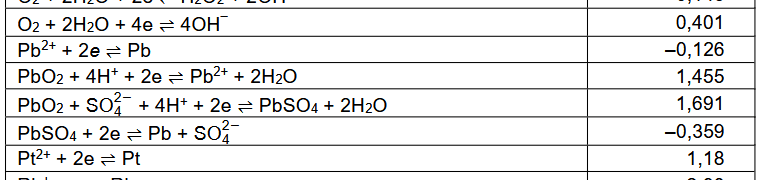
Nie ma go także w "CRC Handbook of Chemistry and Physics, 97th Edithion" (CRC Press, 2017) - źródle, z którego korzystano przy tworzeniu nowych tablic CKE. Za to w obu źródłach jedna wartość wygląda dziwnie znajomo:
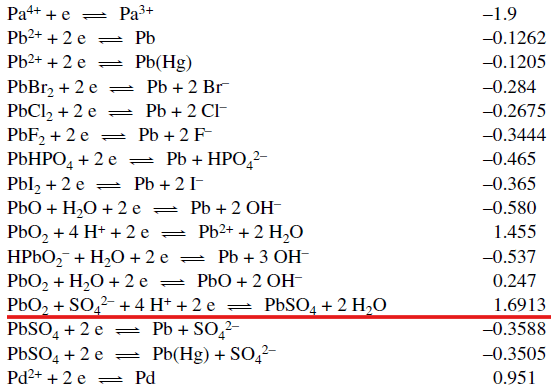
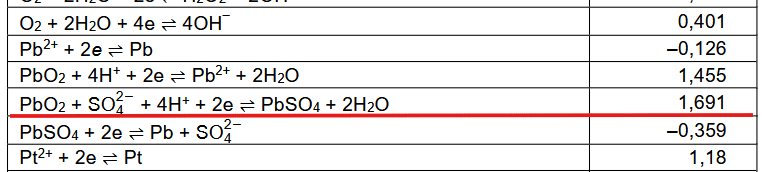
Czy domyślamy się, o co tu chodzi? Po prostu w starych źródłach to samo półogniwo zapisywano jako Pb2+ → Pb4+ + 2e. Dawniej stopnie utlenienia zapisywano także w taki sposób, że wyglądało to na ładunki jonów. I to jest źródłem błędnych wniosków, że można sobie takiego redoksa z roztworem Pb4+ zrobić. A tymczasem to jest redukcja PbO2...
Doświadczenie, które jest przedstawione w zadaniu prawdopodobnie miało być reakcją Cruma - reakcją, w której używa się "Pb4+" - czytaj: PbO2... I to PbO2(s) miał się tam znaleźć, a nie Pb4+(aq). Najsilniejszym utleniaczem nie są jony Pb4+, tylko PbO2.
Przyjrzyjmy się kolejnemu zadaniu:

Wg autorskiej odpowiedzi:
Rozkład CaC2O4 wg podanego równania reakcji jest niemożliwy. Wynika to faktu, że szczawian wapnia rozkłada się do węglanu wapnia wg równania:
CaC2O4 → CaCO3(s) + CO
Rozkład taki zachodzi w temperaturze powyżej 400 °C. Ogrzewanie powstałego CaCO3 do temperatur powyżej 600 °C powoduje jego rozkład na tlenki:
CaCO3(s) → CaO(s) + CO2(g)
Wyobraźmy sobie, że w komorze grzewczej termograwimetru umieszczamy w osobnych naczyniach szczawian wapnia i kalcyt (CaCO3). Następnie rozpoczynamy ogrzewanie. Najpierw dochodzimy do temperatury 400 °C i masa naczynia z CaC2O4 spada. W tej temperaturze masa naczynia z CaCO3 się nie zmienia. Temperatura rośnie nadal, cały szczawian wapnia zdążył się rozłożyć już na CaCO3 zanim temperatura osiągnęła wartość 600 °C. Teraz dopiero następuje rozkład CaCO3 - maleje masa obu naczyń. Nawet na Wikipedii znajdziemy termogram rozkładu CaC2O4 na potwierdzenie tego. Z tą różnicą, że materiałem startowym jest hydrat CaC2O4·H2O:
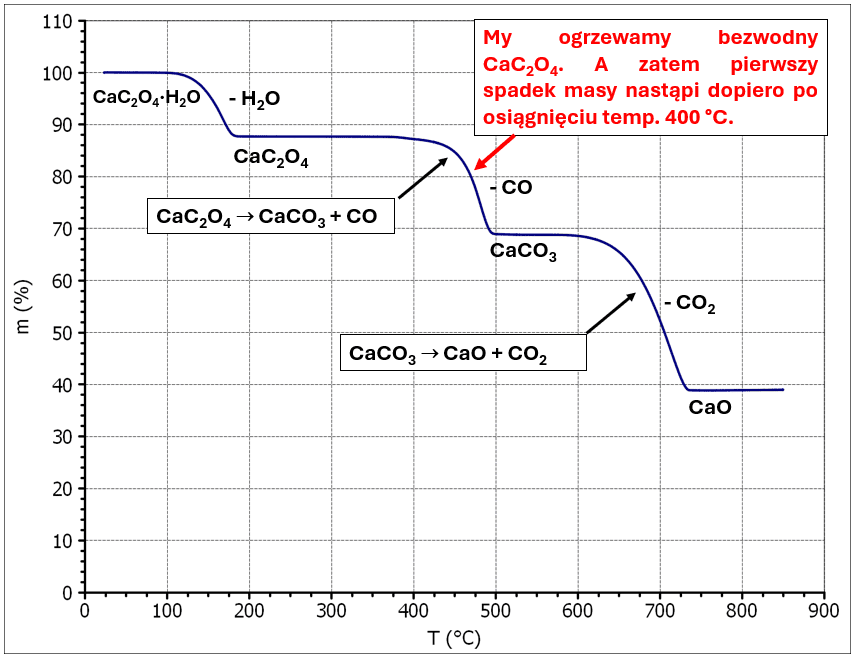
Ponieważ CaCO3 ma większą stabilność termiczną, to nie możliwości by oba procesy (rozkładu szczawianu i rozkładu kalcytu) biegły równocześnie i to taką szybkością, by powstający CaCO3 na bieżąco rozkładał się na CaO i CO2 - a właśnie taką sytuację można by opisać jednym równaniem reakcji:
CaC2O4(s) → CaO(s) + CO2(g) + CO(g)
Nie jest więc możliwe, by ogrzewana próbka zawierała jedynie CaC2O4 i CaO. Najpierw będzie powstawał wyłącznie CaCO3, więc otrzymujemy mieszaninę CaC2O4 z CaCO3.
Rozkład wg podanego równania reakcji byłby możliwy tylko wtedy, gdyby CaC2O4 był bardziej stabilny termicznie niż CaCO3. Czyli musiałoby być na odwrót, np. CaCO3 rozkładałby się już w 400 °C, a CaC2O4 dopiero powyżej 600 °C. Wyobraźmy sobie, jakby to wyglądało: w komorze grzewczej termograwimetru umieszczamy w osobnych naczyniach szczawian wapnia i kalcyt (CaCO3). Następnie rozpoczynamy ogrzewanie. Najpierw dochodzimy do temperatury 400 °C i masa naczynia z CaCO3 spada. Masa naczynia z CaC2O4 się nie zmienia. Temperatura rośnie nadal, cały węglan wapnia zdążył się rozłożyć na CaO zanim temperatura osiągnęła wartość 600 °C i masa naczynia z CaO się już nie zmienia. Teraz dopiero następuje rozkład CaC2O4 - maleje masa drugiego naczynia. Ale w temperaturze 600 °C nie istniałby już CaCO3.... A zatem CaCO3 powstający z rozkładu szczawianu od razu rozkładałby się na CO2 i CaO, bo byłby poza zakresem swojego istnienia. I bilans stechiometryczny zamknąłby się w równaniu sumarycznym podanym w zadaniu i otrzymalibyśmy mieszaninę CaC2O4 z CaO.
Ale tak by było, gdyby CaCO3 rozkładał się w niższej temperaturze niż CaC2O4. A tak nie jest.
Co ciekawe, to zadanie pochodzi ze zbioru obejmującego zadania z matury w roku 2020. Zobaczmy więc na inne zadanie, z którym w 2020 roku mierzyli się maturzyści. I zwróćmy uwagę na podkreślony fragment zdania:

A zatem oba zadania znajdują się w tym samym zbiorze. Czy widzimy brak spójności pomiędzy tymi zadaniami? Jeśli próbka zawiera CaO, to nie zawiera CaC2O4 - bo zasadniczo nie może go wtedy już zawierać.
Czy równanie podane w zadaniu:
CaC2O4 → CaO + CO2 + CO
zupełnie nie ma sensu? Ma, ale tylko po jednym warunkiem. Że przedstawia ono bilans stechiometryczny w którym pokazujemy stan początkowy i stan końcowy, gdy jedyną substancją stałą w próbce był już CaO. Wtedy z 1 mola szczawianu wapnia po ogrzewaniu próbki do temperatur ponad 600 °C tak długo, aż jej masa przestanie się zmieniać (tzn, że cały CaCO3 rozłożył się już na CaO) otrzymamy 1 mol CaO, 1 mol CO i 1 mol CO2. I to równaniu wyrażałoby jedynie sumaryczny bilans tego procesu.
Tym razem przeanalizujemy pod kątem poprawności zaplanowania doświadczenia i odpowiedzi do niego.

I teraz przyjrzyjmy się oryginalnej odpowiedzi:

Czyli odpowiedź ta brzmi: "
Po dodaniu heksanu do wody bromowej obserwujemy rozwarstwienie roztworu. Dzieje się tak dlatego, że heksan jest niepolarny nie miesza się z wodą bromową. Po ogrzaniu probówki pomarańczowy roztwór odbarwia się."
Odpowiedź ta jest błędna.
Błędnie użyte stwierdzenie: rozwarstwienie roztworu - aby takie zjawisko zaobserwować, początkowo w probówce po dodaniu heksanu musiałby się utworzyć układ jednorodny (roztwór). Takie zjawisko jednak nie następuje, bo jak czytamy dalej, heksan nie miesza się z wodą bromową. Nie ma możliwości by zaobserwować rozwarstwienie - po prostu w probówce są od początku dwie fazy (warstwy) ciekłe. Rozwarstwienie można zaobserwować np. podczas wypierania zasadą sodową aniliny z jej soli - anilina, jak znacznie gorzej rozpuszczalna w wodzie - opuszcza środowisko reakcji i tworzy osobną warstwę. Obserwujemy więc, że jednorodna mieszanina rozwarstwia się. W przypadku tego zadania poprawniej byłoby stwierdzić, że ciecze tworzą dwie (osobne) warstwy.
Alkany reagują z chlorem lub bromem na świetle lub w wysokich temperaturach. Należy jednak odróżniać wysoką temperaturę od temperatury podniesionej, tj. powyżej temperatury otoczenia/pokojowej. Np. umieszczając probówkę w gorącej łaźni wodnej prowadzimy reakcję w podniesionej temperaturze, a nie wysokiej. Nawet ogrzewając probówkę palnikiem nie osiągniemy pewnych temperatur, jeśli w probówce jest jakiś wodny układ (woda wrze w 100 °C pod ciśnieniem normalnym) - tak samo jak zupa w garnku nie osiągnie temperatury 300 °C pomimo tego, że płomień ma ok. 1000 °C. Co zaobserwujemy ogrzewając probówkę z heksanem i wodą bromową? Brom wrze w 59 °C, n-heksan w 69 °C, a woda w 100 °C (wszystko przy ciśnieniu 1013 hPa, czyli zbliżonego do ciśnienia, w którym żyjemy). Ogrzewając więc probówkę najpierw przekraczamy temperatury wrzenia bromu i heksanu. Dodatkowo sprawę komplikuje fakt, że woda i n-heksan tworzą mieszaninę azeotropową o temperaturze wrzenia... 59 °C. Oznacza to, że gdy zawartość probówki osiągnie 59 °C, to całość zacznie wrzeć i opuszczać probówkę w postaci par. Termiczne halogenowanie prowadzi się temperaturach rzędu 300 - 400 °C. Takich warunków nie da się osiągnąć w otwartej probówce z wodą bromową i heksanem, z ww. powodów. A probówki z założenia służą do przeprowadzania reakcji w fazie ciekłej, a nie gazowej.
Brak możliwości osiągnięcia odpowiednich temperatur w podanym układzie nie oznacza, że w probówce nie zaobserwujemy żadnych zmian. Brom, jako niepolarny, dobrze rozpuszcza się w niepolarnych cieczach (jak węglowodory, chlorowcopochodne węglowodorów). Możemy to zobaczyć na poniższej fotografii.

większość bromu przechodzi do fazy organicznej i powoduje to zabarwienie tej warstwy. Nazywamy to ekstrakcją - ze zjawiskiem tym spotkaliśmy się już na złowieszczej próbnej maturze CKE w grudniu 2022:

Podobnie na ostatniej próbnej maturze UJ:

Probówka 1. przedstawia jak wygląda zawartość probówki po zmieszaniu chloroformu i wody bromowej - ten sam układ jest na pierwszej fotografii. Nie można więc powiedzieć, że po ogrzaniu roztwór się odbarwia - odbarwia się (choć niecałkowicie) i na zimno.
Oczywiście doświadczenia na ogół wykonujemy przy oświetleniu - chcemy przecież widzieć, co się dzieje w probówce. Z czasem więc zawartość probówki się odbarwi i nie ma znaczenia, czy tę probówkę ogrzejemy nieco, czy też nie. Szczególnie szybkie odbarwienie (mniej niż 5 min) następuje po wystawieniu na światło słoneczne:

polecam także: "Reakcje rodnikowe: benzen i brom".
Tym razem przyjrzyjmy się temu zadaniu i odpowiedzi do niego:

To zadanie nie powinno się znaleźć w zbiorze dla maturzystów. Zauważmy, że gdyby rozpatrywana reakcja zachodziła "na sucho":
2NaHCO3(s) ⇄ Na2CO3(s) + CO2(g) + H2O(g)
to nie mielibyśmy większego problemu z zapisaniem wyrażenia na stałą równowagi (stężeniową):
Kc = [CO2][H2O]
Wracając do zadania: reakcja II jest niejasna - jak zapisać wyrażenie na stałą równowagi w tym przypadku? Widzimy, że CO2 opuszcza układ jako gaz. Stężenie gazu nad fazą skondensowaną jest więc zmienne, a w wyrażeniu na stałą równowagi uwzględniamy zmienne. Jednakże substrat jest rozpuszczony w wodzie, czyli w roztworze. W miarę postępu reakcji zmienia się nie tylko masa poszczególnych składników, ale także ich stężenie. Stężenia wszystkich składników są więc zmienne.
Oznacza to, że nie można ich tak sobie pominąć. Ta reakcja to przykład równowagi złożonej. Jedna ustala się w roztworze:
2NaHCO3(aq) ⇄ Na2CO3(aq) + CO2(aq) + H2O(aq)
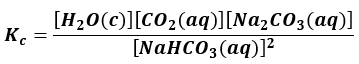
Ale druga ustala się pomiędzy roztworem a fazą gazową:
CO2(aq) ⇄ CO2(g)
Rozpuszczalność gazów zależy od ciśnienia gazu nad roztworem, o czym mówi prawo Henry'ego. A odpowiednią stałą równowagi tego procesu nazywamy stałą Henry'ego. W naszym przypadku:
KH =[CO2(g)]/[CO2(aq)]
Ale jest to wiedza zdecydowanie ponad zakres maturalny. Skąd więc takie zadanie w zbiorze dla maturzystów? Ale spróbujmy to rozwiązać jak należy. Ponieważ są to procesy następcze, to możnaby założyć, że wypadkowa wartość stałej równowagi jest iloczynem Kc i KH:
K = Kc ∙ KH
Ale ten iloczyn nie prowadzi nas do wyrażenia:
K = [CO2]
Jak możemy sami się przekonać wykonując odpowiednie mnożenie. Jeszcze inaczej mówiąc: jest to przypadek, w którym równowagowe stężenie CO2 nad roztworem zależy od początkowego stężenie roztworu NaHCO3. Z kolei w reakcji "na sucho" sytuacja taka nie ma miejsca, bo stężenie ciała stałego jest jest niezmienne. Szerzej o stałych równowagi w układach niejednorodnych piszę tutaj.
Przyjrzyjmy się temu zadaniu maturalnemu (czerwiec 2023, formuła 2023) i odpowiedzi do niego:
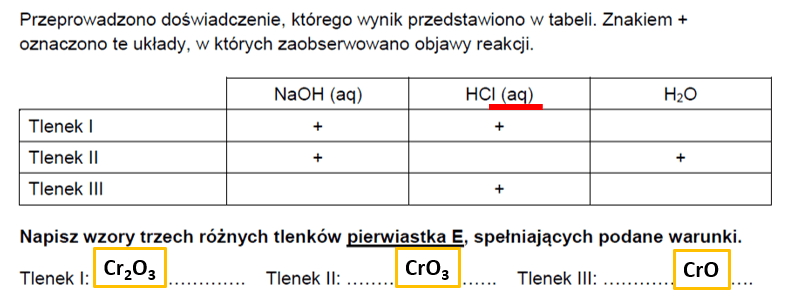
Wynika z tego, że w probówce z HCl nie zaobserwowano objawów reakcji. I tutaj wiele osób zacznie to tradycyjnie uzasadniać: "No tak, tlenki kwasowe nie reagują z kwasami". Ale CrO3 reaguje z wodą, jak sama tabela wskazuje. A czym jest kwas solny, czyli HCl(aq)? WODNYM roztworem chlorowodoru. Czyli WODNYM roztworem HCl w H2O. A z H2O, jak widzimy w tabeli, nasz CrO3 reaguje, tworząc kwas chromowy(VI):
CrO3 + H2O → H2CrO4
I już chociażby z tego powodu tabela podaje błędną informację. Bo przecież to, że w tej wodzie jest już rozpuszczony HCl nie sprawia, że woda obrazi się na CrO3 i nie zechce z nim reagować. Nie jest prawdą, że tlenki kwasowe nie reagują z kwasami - po prostu nie tworzą (na ogół) soli w reakcji z innym kwasem lub innym tlenkiem kwasowym. Ot, w jaki sposób otrzymać kwas disiarkowy(VI)? Np. tak:
H2SO4 + SO3 → H2S2O7
Tlenek kwasowy przereagował z kwasem. Ponadto nawet w przypadku otrzymywania H2SO4, to przecież pierwsze porcje SO3 reagują z wodą, ale kolejne reagują z wodnym roztworem H2SO4. Czyli z kwasem siarkowym(VI) - bo kwasem siarkowym(VI) nazywamy nie tylko związek o wzorze H2SO4, ale takze jego wodne roztwory (stąd mamy stężony i rozcieńczony kwas siarkowy(VI)). Ale jest jeszcze coś, o czym maturzyści nie wiedzą raczej. Tlenek kwasowy może reagować z innym kwasem, i tak np. CrO3 reaguje z kwasem solnym dając chlorek chromylu CrO2Cl2:
CrO3 + 2HCl → CrO2Cl2 + H2O
I na tej reakcji (ale nie tylko na tej konkretnej) są oparte metody otrzymywania tego związku. Wkrótce pokażę to na filmie (ale po 21.04.24). A kiedyś tzw. próbę chromylową wykonywali prawie wszyscy studenci.
Ta szkolna regułka: "tlenki kwasowe nie reagują z kwasami, reagują z zasadami" jest przekłamaniem o mógłby podać bardzo liczne przykłady, że jest błędna. Po prostu nie dają soli w reakcji pomiędzy sobą, ale to nie znaczy, ze nie reagują.
W świetle zbliżajacej się matury z chemii dodam, szczególnie dla osób, które zamierzają zapytać teraz: "A na maturze to jak mamy pisać?", "A do matury to jak mamy ich uczyć?", to dodam: "Tłuste plamy".
Nie wszyscy wiedzą o co chodzi? W odpowiedziach do zadania 18 do arkusza z czerwca 2016 widzimy takie propozycje:

Nadchodzi maj 2018, pojawia się podobna reakcja z wyparciem fenolu, masa ludzi pisze o tłustych plamach w obserwacjach i... dostaje za taką odpowiedź zero punktów.
BO UCZYĆ SIĘ I UCZYĆ INNYCH DO MATURY NALEŻY TAK, ŻEBY BYŁO DOBRZE. A nie powtarzać w kółko, że piszemy tak, bo tak było na maturze - bo nawet na maturze lub w odpowiedziach mogły się pojawić pomyłki, co w żaden sposób nie usprawiedliwia powielania tej pomyłki, "bo tak było na maturze". Było, ale więcej nie musi być. I w sytuacji z CrO3 także można się spodziewać, że taka sytuacja już sie nie powtórzy, bo ktoś zauważy lub pod wpływem zgłoszonych uwag skoryguje to odpowiednio w przyszłości. Oczywiście nie życzę Wam, by na waszej maturze znalazło się coś, co się tam znaleźć nie powinno. I oby tak było!
Tym razem o błędzie popełnionym przez niedopatrzenie, ale chyba nikt z tych kilkuset osób piszących maturę w czerwcu nie stracił z tego powodu punktów. Ale gdy analizować to zadanie na spokojnie, to wiele osób wyszukuje sobie w internecie wzór oksytocyny i ma zagwozdkę. I tak zresztą to zadanie trafiło do mnie, nadesłane przez jedną ze znajomych nauczycielek chemii, której coś nie pasowało patrząc na wzór półstrukuralny oksytocyny i na odpowiedzi "w kluczu". Najpierw samo zadanie:
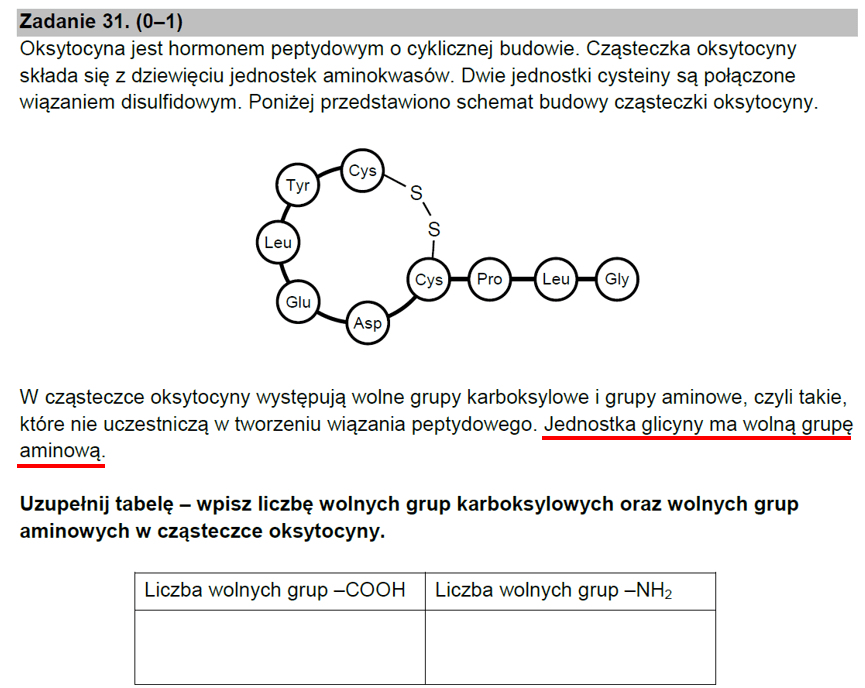
Z informacji w zadaniu wynika, że jednostka glicyny jest N-końcem cząsteczki, zatem sekwencja aminokwasów to Gly-Leu-Pro-Cys-Asp-Glu-Leu-Tyr-Cys. Wynika z tego, że jednostka cysteiny z drugiego końca cząsteczki musi mieć wolną grupę karboksylową. Tymczasem popatrzmy na wzór półstrukturalny oksytocyny. Wziąłem go z wikipedii, bo jest poprawny. I tu mała niespodzianka, bo jednostka cysteiny ma wolna grupę NH2... A jej grupa karboksylowa została została wykorzystana do utworzenia wiązania peptydowego. Nie może być więc C-końcem...
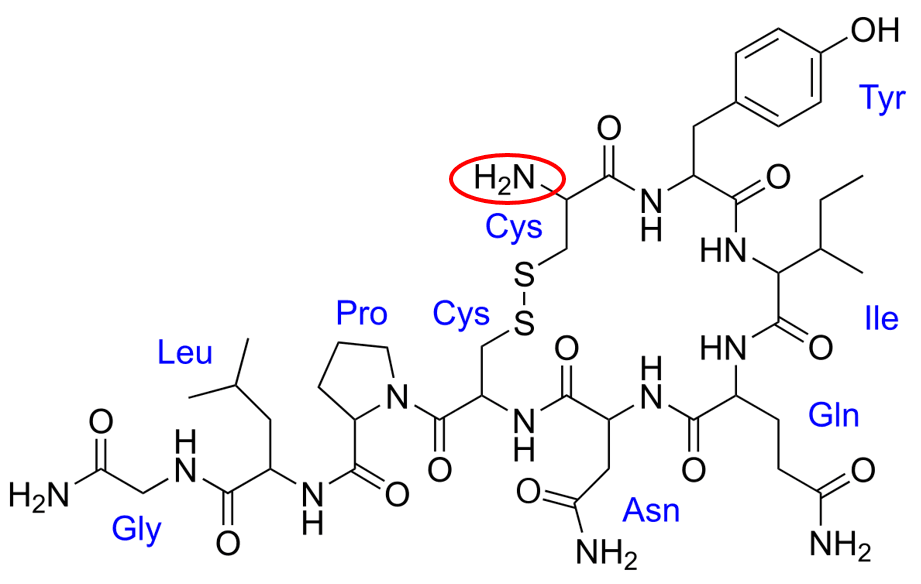
No dobrze, ale po lewej na dole jednostka glicyny także ma grupę NH2...
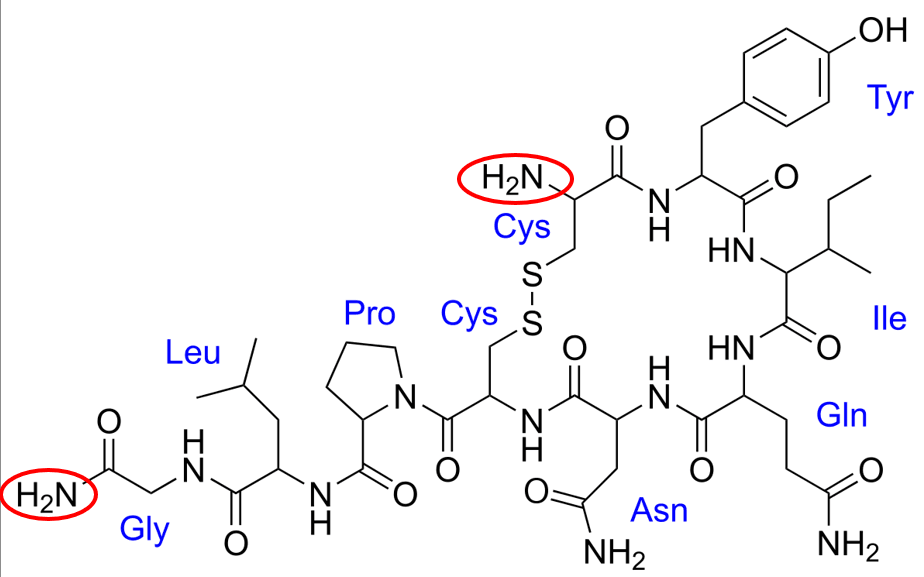
Czy to oznacza, że mamy 2 N-końce w tym łańcuchu? Nie, po prostu to sprawdzian spostrzegawczości dla autora zadania. Taka N-Końcowa jednostka glicyny miałaby wzór NH2-CH2-CO-. Tymczasem widzimy NH2-CO-CH2-NH- - to nawet nie jest wiązanie peptydowe! To grupa amidowa, a nie wolna grupa NH2 (aminowa). O co więc chodzi? Dopiero jak popatrzymy uważniej, to dostrzeżemy, że właściwe ugrupowanie glicynowe jest trochę gdzie indziej i odpowiada to -CO-CH2-NH-.
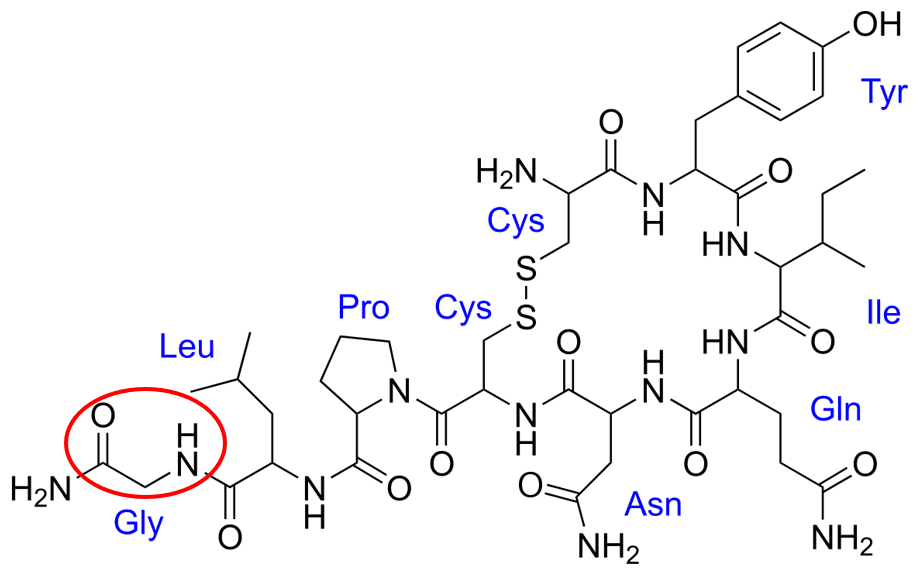
Czyli grupa aminowa glicyny została wykorzystana do utworzenia wiązania peptydowego. Ta jednostka jest więc ugrupowaniem C-końcowym. To dlaczego nie ma wolnej grupy COOH? Bo peptyd ten ulega obróbce posttranslacyjnej:
R-CO-OH → R-CO-NH2
I gdyby zapisać ogólny wzór peptydów od N-końca do C-końca tak: H-[CHR-CO]n-OH, to w przypadku oksytocyny mielibyśmy (bez uwzględniania, że dodakowo powstaje mostek disiarczkowy): H-[CHR-CO]n-NH2. A sekwencja aminokwasowa to: Cys-Tyr-Leu-Glu-Asp-Cys-Pro-Leu-Gly.
Ale to jeszcze nie wszystko! Zupełnie zapomniałem (ale mi swoim pytanmiem ktoś przypomniał o tym). Bo ile pewne rzeczy można wyjaśnić zwykłym niedopatrzeniem, o tyle przyjrzyjmy się tej sekwencji jeszcze raz: Cys-Tyr-Leu-Glu-Asp-Cys-Pro-Leu-Gly - tak jest w treści zadania po ustaleniu, który koniec jest N-końcem. A teraz porównajmy to z sekwencją podawana przez wszystkie inne źródła: Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly. Nie zgadzają się jednostki aminokwasowe! Czy to dużo zmienia? Tak. Nawet gdyby nie uwzględnić obróbki postransalcyjnej, to prawdziwa cząsteczka oksytocyny miałaby jedną wolną grupę COOH (rzeczywista cząsteczka nie ma żadnej). Z zadania wynika, że powinny być 3, bo Asn (reszty asparaginy) na Asp (resztę kwasu sparaginowanego i Gln (reszty glutaminy) na Glu (resztę kwasu kwasu glutaminowego) wprowadza w bocznych łańcuchach dwie dodatkowe grupy karboksylowe. Tymczasem ta jedyna zostaje przekształcona w obróbce postranslacyjnej w CONH2... I z tego powodu sekwencja jednostek aminokwasowych czxęsto zapisywana jest tak: Cys-Tyr-Leu-Glu-Asp-Cys-Pro-Leu-Gly-NH2.
No a teraz można policzyć wolne grupy COOH i NH2 :)
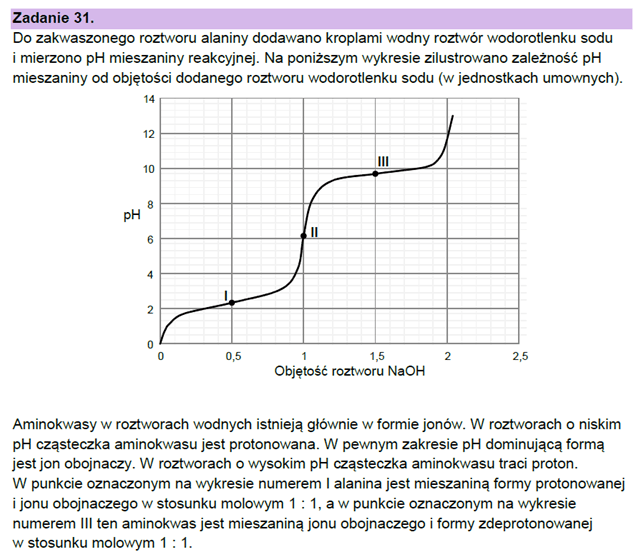
Najpierw przyjrzyjmy się zadaniu 31 z maja 2023. To zadanie skonstruowane jest poprawnie i odpowiedź do niego także jest poprawna!

Ale już odpowiedź do zadania z czerwca 2019 zawiera błąd:
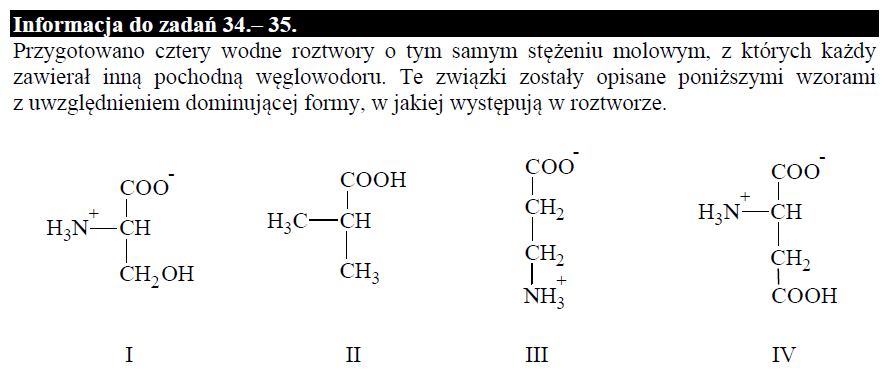

Wg schematu oceniania: 1 - P, 2 - F, 3 - F.
Zwróćmy uwagę na odpowiedź do zadania 1: P.
Dość powszechnie spotyka się przekonanie, że w roztworze o pH<pI dominuje forma kationowa aminokwasu, a w roztworze o pH>pI dominuje frma anionowa. Jest to przekonanie błędne. Oznaczało by to, że istnieje jakaś magiczna wartość pH, w której w miarę podnoszenia pH roztworu w cudowny sposób, bez zachowania ciągłości równowagi w roztworze, zmienia się stężenie poszczególnych form aminokwasów w sposób skokowy. No bo np. dla glicyny (pI=6,11) w roztworze o stężeniu 0,1 mol/dm3 - mamy praktycznie 0,1 mol/dm3 formy obojnaczej. A jak pH pH spadnie do wartosci 6,10, to więcej zrobi się formy kationowej, niż obojnaczej? Przecież to mikroskopijny dodatek kwasu! Jonów obojnaczych jest tam miliardy razy więcej, niż dodatkowych kationów oksoniowych. Jeśli w litrze roztworu mamy 0,1 mola jonów obojnaczych, to żeby sprotonować połowę potrzebujemy 0,05 mola kationów oksoniowych... A to oznacza spadek pH znacznie poniżej pI... Przyjrzyjmy się temu tej zależności zawartości form (tzw. specjacji) w roztworze glicyny w zależności od pH roztworu (w 25 °C). Wykresik wziąłem z Wikipedii. Na wykresie akronimem GlyH oznaczono formę obojętną (jon obojnaczy), GlyH2 - formę kationową (protonowaną), Gly - formę anionową (deprotonowaną).
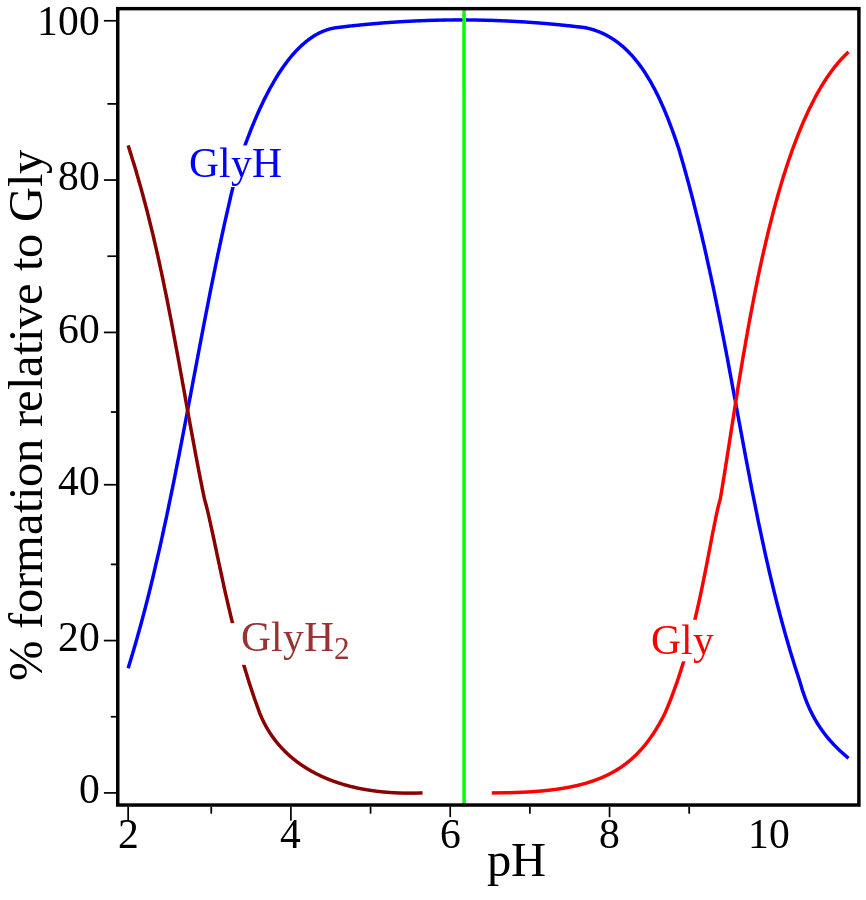
Dla glicyny tą graniczną wartością, poniżej której dominuje forma kationowa jest pH=2,34, a nie 6,11... To błędne myślenia wynika ze skojarzeń z elektroforezą. Poniżej pI zaobserwujemy migrację w kierunku katody - bo w roztworze POJAWIĄ SIĘ formy kationowe, a nie, że są tam praktycznie tylko one. Analogicznie powyżej pI POJAWIAJĄ SIĘ formy anionowe, ale dominować zaczną dopiero powyżej pH=9,78. Migracja w kierunku konkretnej elektrody wynika stąd, że w roztworze obecne są jony o określonym ładunku, a nie że dominują! Choć oczywiście mogą - w odpowiednio niskim lub odpowiednio wysokim pH.
Przeanalizujmy teraz wykres z zadania 31 z maja 2023 i porówjamy go z tym z Wikipedi. Choć zadanie dotyczy alaniny, to różnice są niewielkie (identyczne pI, a graniczne wartości pH to 2,46 i 9,41).
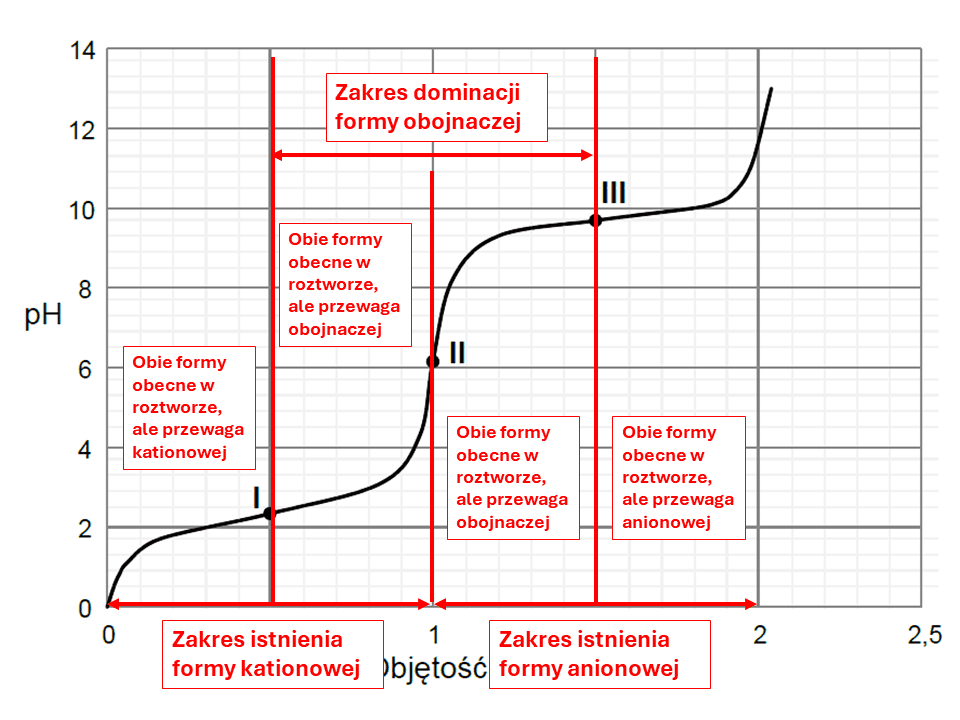
W zadaniu 35. z czerwca 2019 związkiem I jest seryna o pI=5,68. Graniczne wartości to 2,19 i 9,21. W zadaniu mowa o pH<5. Tymczasem aby formą dominującą była forma kationowa, to pH musi być poniżej 2,19. Dalej zwróćmy uwagę, że zadanie z maja 2023 zawiera poprawną informację o tym, że istnieje pewien zakres pH, w którym jon obojnaczy dominuje, co trochę kłóci sie z zadaniem z czerwca 2019, sugerującym, że istnieje tylko taki punkt pH. To jakby wygląda taki wykres w zależności od pH, w którym poniże i powyżej pI od razu formą dominującą byłyby jony o określonym ładunku, a w pI akurat obojnaczy? Cokolwiek ciekawie, ale narysuję go innym razem :)
Pamiętajmy, że matura się zmienia - błędy są stopniowo eliminowane. To, że "kiejsi tak było na maturze/we kluczu" nie znaczy, że następnym razem sytuacja się powtórzy i taka odpowiedź będzie zaliczana, "bo na maturze piszemy że...".
Tym razem przeanalizujemy to zadanie:

I autorską odpowiedź do niego:

Mamy tutaj dwie ciekawe rzeczy:
użycie terminu wydajność, choć chodzi o stopień dysocjacji. Od pewnego czasu obserwują taka ciekawą tendencję u niektórych osób,
Pomylenie rozpuszczalnosci z dysocjacją - typowy szkolny błąd.
Nie spadnie stopień dysocjacji ("wydajność"), tylko rozpuszczalność przez efekt wspólnego jonu. Na2CO3 jest elektrolitem mocnym - wprowadzenie dodatkowych jonów Na+ nie zmniejszy jego stopnia dysocjacji, tylko rozpuszczalność. O spadku stopnia dysocjacji (czyli w tym zadaniu: wydajności dysocjacji) można mówić w przypadku elektrolitów słabych. Dla przykładu: wprowadzenie CH3COONa do roztworu CH3COOH w wodzie spowoduje, zgodnie z regułą przekory, spadek stopnia dysocjacji CH3COOH. To także efekt wspólnego jonu, tylko inny typ równowagi. I w tym przypadku spadnie stopień ("wydajność") dysocjacji, a nie rozpuszczalność, jak w przypadku roztworu Na2CO3.
To pierwsze zadanie-bubel w tej kolekcji, które pochodzi z arkusza maturalnego. Przyjrzyjmy się zadaniom 15 i 16 i odpowiedzi do zadania 16 ze schematu oceniania ("klucza").

O oryginalną odpowiedź "z klucza":

Takie odróżnienie nie jest jednak możliwe, ponieważ w w obu probówkach powstaną dobrze rozpuszczalne związki. Dokładniejsze wyjaśnienie dlaczego znajduje się w filmie poniżej, a artykuł jak posługiwać się tabelą rozpuszczalności by nie wyciągnać błędnych wniosków znajduje się tutaj.
Przeanalizujmy to zadanie:

Autorska odpowiedź mówi, że wynmik to 4,4 g. Ten wynik jest nieprawidłowy, rozxwiązanie polega na zastosowaniu typowego szkolnego błędu. Rozwiązanie oparte jest na przyjęciu, że skoro początkowe stężenie N2O 0,08 mol/dm3, to szybkość początkowa (obliczona z równania kinetycznego) wynosi 0,04 mol∙dm-3∙s-1. To akurat się zgadza. Ale żeby otrzymać wynik 4,4 g (tj. 0,1 mol N2O) autor posłużył się następującym tokiem postępowania:
Stężenie w chwili 0: 0,08 mol/dm3 → szybkość w chwili 0: 0,04 mol∙dm-3∙s-1 → stężenie po 1 sekundzie: (0,08 - 0,04) = 0,04 mol/dm3,
Stężenie po 1 sekundzie: 0,04 mol/dm3 → szybkość w chwili 0: 0,02 mol∙dm-3∙s-1 → stężenie po 2 sekundach: (0,04 - 0,02) = 0,02 mol/dm3,
Stężenie po 2 sekundach: 0,02 mol/dm3 → szybkość w chwili 0: 0,01 mol∙dm-3∙s-1 → stężenie po 3 sekundach: (0,02 - 0,01) = 0,01 mol/dm3,
W całym zbiornika pozostałoby więc:
n = C ∙ V = 0,01 ∙ 10 = 0,1 mol
Co daje 4,4 g. Wynik ten jest nieprawidłowy, a rozumowanmie błędne. Taki tok rozumowania jest prawidłowy tylko w przypadku reakcji zerowego rzędu.
Choć przedstawione obliczenia prowadzące do wyniku 4,4 g są proste, to tego typu zadanie nigdy nie pojawiło sie na maturze z chemii. A wynika to z faktu, że prawidłowo prowadzono obliczenia w przypadku reakcji o rzędzie różnym od zerowego - wykraczaja ponad wymagania egzaminacyjne. Dopiero po zaopatrzeniu w odpowiednią informacje wstępną takie zadanie mogłoby pojawić sie na maturze. W oryginalnej formie jest ono nie do policzenia przez maturzystę, a przedstawione obliczenia, którymi posłużył się autor - są błędne i wprowadzają w błąd osoby, które rozwiązują to zadanie.
Dokładnie wyjaśnienie czym jest szybkość reakcji i co pozwala obliczyć równanie kinetyczne znajduje sie tutaj:
Na identycznym błędnym założeniu oparte jest rozwiązanie np. jeszcze tego zadania:
