Tym razem przyjrzyjmy się temu zadaniu i odpowiedzi do niego:

To zadanie nie powinno się znaleźć w zbiorze dla maturzystów. Zauważmy, że gdyby rozpatrywana reakcja zachodziła "na sucho":
2NaHCO3(s) ⇄ Na2CO3(s) + CO2(g) + H2O(g)
to nie mielibyśmy większego problemu z zapisaniem wyrażenia na stałą równowagi (stężeniową):
Kc = [CO2][H2O]
Wracając do zadania: reakcja II jest niejasna - jak zapisać wyrażenie na stałą równowagi w tym przypadku? Widzimy, że CO2 opuszcza układ jako gaz. Stężenie gazu nad fazą skondensowaną jest więc zmienne, a w wyrażeniu na stałą równowagi uwzględniamy zmienne. Jednakże substrat jest rozpuszczony w wodzie, czyli w roztworze. W miarę postępu reakcji zmienia się nie tylko masa poszczególnych składników, ale także ich stężenie. Stężenia wszystkich składników są więc zmienne.
Oznacza to, że nie można ich tak sobie pominąć. Ta reakcja to przykład równowagi złożonej. Jedna ustala się w roztworze:
2NaHCO3(aq) ⇄ Na2CO3(aq) + CO2(aq) + H2O(aq)
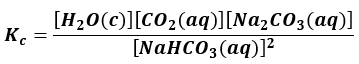
Ale druga ustala się pomiędzy roztworem a fazą gazową:
CO2(aq) ⇄ CO2(g)
Rozpuszczalność gazów zależy od ciśnienia gazu nad roztworem, o czym mówi prawo Henry'ego. A odpowiednią stałą równowagi tego procesu nazywamy stałą Henry'ego. W naszym przypadku:
KH =[CO2(g)]/[CO2(aq)]
Ale jest to wiedza zdecydowanie ponad zakres maturalny. Skąd więc takie zadanie w zbiorze dla maturzystów? Ale spróbujmy to rozwiązać jak należy. Ponieważ są to procesy następcze, to możnaby założyć, że wypadkowa wartość stałej równowagi jest iloczynem Kc i KH:
K = Kc ∙ KH
Ale ten iloczyn nie prowadzi nas do wyrażenia:
K = [CO2]
Jak możemy sami się przekonać wykonując odpowiednie mnożenie. Jeszcze inaczej mówiąc: jest to przypadek, w którym równowagowe stężenie CO2 nad roztworem zależy od początkowego stężenie roztworu NaHCO3. Z kolei w reakcji "na sucho" sytuacja taka nie ma miejsca, bo stężenie ciała stałego jest jest niezmienne. Szerzej o stałych równowagi w układach niejednorodnych piszę tutaj.