„Woda amoniakalna to NH3∙H2O” – ile razy to słyszeliśmy? Zdecydowanie dużo… Za dużo.
Zastanówmy się, czy wzór kwasu solnego to HCl·H2O czy HCl(aq)? Tylko ten drugi, ale właściwie, to dlaczego?
Co oznacza wzór CuSO4∙H2O? Czy może on oznaczać wzór roztworu CuSO4 w wodzie? Takie wzory z kropką w środku stosuje się w przypadku związków addytywnych (adduktów): połączenia co najmniej dwóch substancji chemicznych w jedność. Mają ściśle określony skład i określone właściwości, takie jak barwa, gęstość, temperatura topnienia, temperatura wrzenia, rozpuszczalność w innych substancjach itd. Addukty na ogół istnieją w pewnych warunkach. Przykładem adduktów są hydraty. Siarczan(VI) miedzi(II) tworzy z wodą kilka adduktów, m.i. CuSO4∙H2O, a także wszystkim znane niebieskie kryształy CuSO4∙5H2O.

CuSO4, CuSO4·H2O, CuSO4·3H2O, CuSO4·5H2O i CuSO4·7H2O mają ściśle określony skład i ściśle określone właściwości – każdy z nich jest osobną substancją chemiczną. Wszystkie mają zatem inne numery CAS (Chemical Abstracts Service) – chemiczny „numer PESEL”.
Jeśli wrzucić do odpowiedniej ilości wody CuSO4 (tzw. bezwodny siarczan(VI) miedzi(II)), to otrzymamy roztwór CuSO4 o charakterystycznej, niebieskiej barwie. Intensywność tej barwy zależy od stężenia, jak widzimy na poniższej fotografii.

Ale… W wodzie rozpuszczają się także CuSO4·5H2O i inne hydraty tworzone przez CuSO4 – co w wyniku tego otrzymujemy? Niebieski roztwór, którego intensywność barwy zależy od stężenia. Dokładnie taki sam, jak po rozpuszczeniu CuSO4 (bezwodnego siarczanu(VI) miedzi(II)). Niczym się on nie różni. Ale dlaczego? Bo za każdym razem otrzymujemy to samo: jony miedzi(II) i siarczanowe(VI) poruszające się pomiędzy cząsteczkami wody, których jest znacznie więcej.
Inaczej mówiąc – jeśli dostaję niebieski roztwór CuSO4, to nie wiem w jaki sposób został przygotowany. Mogłem rozpuścić bezwodny CuSO4, albo dowolny addukt tego związku z wodą (hydrat). Po prostu tego nie wiem, bo rozpuszczenie każdego z nich daje to samo. Hydraty nie istnieją w wodnych roztworach. Gdyby istniały, to roztwór otrzymany z bezw. CuSO4 miałby inne właściwości niż roztwór CuSO4·H2O, a jeszcze inne miałby roztwór CuSO4·5H2O. Ale nie ma, bo te hydraty nie istnieją w roztworze. Wzór CuSO4·H2O albo innego hydratu jako „wzór roztworu CuSO4” nie ma prostu sensu.
Jeśli otrzymamy nasycony roztwór CuSO4 w wodzie i zaczniemy go ochładzać, to wskutek spadku rozpuszczalności z roztworu zaczną wypadać niebieskie kryształy. Kryształy o wzorze CuSO4·5H2O, czyli addukt. Tylko teraz ten wzór ma sens.

Błędem jest mówienie o wodnych roztworach hydratów, skoro one w wodzie nie istnieją, a roztwory nie mają ściśle określonego składu. Nie ma roztworu CuSO4·5H2O, jest roztwór CuSO4.
To jaki jest wzór roztworu CuSO4 w wodzie? Co najwyżej CuSO4(aq). Przyrostek (aq) podkreśla nam, że mamy do czynienia z wodnym roztworem. Dlatego też kwas solny to HCl(aq) – podkreślamy, że ten chlorowodór jest rozpuszczony w wodzie.
Wzory stosujemy dla substancji chemicznych: ściśle określonych połączeń chemicznych, które dzięki stałości składu mają też określone właściwości, np. woda to zawsze H2O i wrze w 100 °C pod normalnym ciśnieniem. Substancją chemiczną są też addukty. Roztwory nie są substancjami chemicznymi, tylko ich mieszaninami. Mieszaniny nie mają ściśle określonego składu i ściśle określonych właściwości. I nie mają wzoru chemicznego. Co więc oznaczają wzory HCl(aq) i NaOH(aq)? Tylko to, w jakiej postaci znajduje się dana substancja: jest rozpuszczona w wodzie. Podczas zobojętniania zasady sodowej kwasem solnym zachodzi reakcja opisana równaniem:
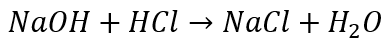
Reakcję tę możemy przeprowadzić (i najczęściej tak robimy) mieszając wodne roztwory substratów (zasadę sodową i kwas solny). Możemy to uwzględnić w równaniu reakcji:
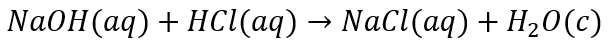
Produktem jest wodny roztwór NaCl.
Ale mogłem przepuszczać gazowy chlorowodór przez wodny roztwór NaOH. I też to podkreślić w równaniu reakcji:
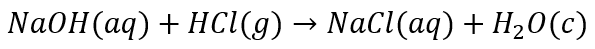
Możliwości jest więcej i nie trzeba się ograniczać do wody jako rozpuszczalnika. We wszystkich przypadkach zajdzie ta sama reakcja chemiczna:
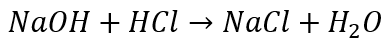
Nic się nie stanie, jeśli równanie reakcji napiszemy w tej postaci. Przyrostki typu (g), (c), (s), (aq) itp. informują tylko w jakiej postaci znajdują się substraty i produkty. Na obliczenia stechiometryczne nie ma to wpływu, ale może być informacją dla czytelnika np. jakich obserwacji się spodziewać, jak oddzielić żądany produkt od innych produktów itp.
Zajmijmy się w końcu wodą amoniakalną. To roztwór amoniaku w wodzie, czyli mieszanina wody i amoniaku. Amoniak bardzo dobrze rozpuszcza się w wodzie, stąd stężenie amoniaku w wodzie zmienia się w szerokich granicach: w temperaturze 25 °C przy normalnym ciśnieniu od 0% do 25%. Stąd możemy mówić o stężonej i rozcieńczonej wodzie amoniakalnej.
Ile cząsteczek wody przypada na 1 cząsteczkę NH3 w roztworze o stężeniu 25%? 2,83. Zatem jak to się ma do tego wzoru NH3·H2O? Nijak… Co więcej, to jeśli będziemy ochładzać stężoną wodę amoniakalną, to w pewnych temperaturach zaczną się w niej pojawiać kryształy o wzorze NH3·H2O, a z bardziej stężonych roztworów nawet kryształy o wzorze 2NH3·H2O (lub inaczej: NH3·0,5H2O). To co jest wzorem wody amoniakalnej: NH3·H2O, czy NH3·0,5H2O? Żaden z nich. Takie kryształy opuszczają wodę amoniakalną, a nie są wodą amoniakalną.
Pikanterii sprawie dodaje fakt, że ochładzając kwas solny (układ H2O i HCl) także otrzymamy kryształy hydratów: HCl·H2O, HCl·2H2O, HCl·3H2O czy HCl·6H2O. To jaki jest wzór kwasu solnego? Po prostu HCl lub HCl(aq). Żaden z adduktów nie jest kwasem solnym. I żaden z adduktów nie jest wodą amoniakalną.
A ochładzając wodę chlorową otrzymamy kryształy o wzorze Cl2·8H2O – to jest to wzór wody chlorowej czy czegoś, co tę wodę opuszcza?
Nagminnie stosuje się w szkolnictwie wzór NH3·H2O wmawiając uczniom, że to wzór wody amoniakalnej. Ale wzór ten jest nieprawdziwy dla wody amoniakalnej… Czyli herezję o NH4OH zastąpiono (nieco mniejszą) herezją. Czy więc powinno się przy niej obstawać? Zapis ten nie dość że błędny, to jest też źródłem błędów i nieporozumień.
To jaki w końcu ma wzór woda amoniakalna? Po prostu NH3 lub NH3(aq), a nie jakieś NH3·H2O, bo to jest wzór czegoś, co tę wodę opuszcza w postaci ciała stałego, a nie woda amoniakalna. Ale zaraz! To dlaczego podręczniki szkolne i nauczyciele wmawiają nam, że NH3·H2O? No właśnie! Bo tak ktoś kiedyś zaproponował – prawdopodobnie jest to jeden z pomysłów K. Pazdro. I chociaż tego człowieka szanuję za jego wkład w edukację chemiczną, to jednak nie wszystkie jego pomysły są trafione i mają rację bytu. Zwłaszcza takie, które nieprawidłowo używają jakichś wzorów i są źródłem zamieszania. Błędy omówimy sobie na końcu.
Amoniak w roztworach wodnych ulega „uwodnieniu” – poprzez tworzenie wiązań wodorowych. Oddziaływanie pomiędzy atomem wodoru cząsteczki wody, a wolną parą elektronową atomu azotu H3N----H–O–H jest typowym wiązaniem wodorowym. Ale wiązania wodorowe z cząsteczkami wody tworzy większość związków, które w tej wodzie rozpuścimy. Dlatego więc nie zapisujemy np. CH3COOH·H2O jako wzór octu? Dlaczego to jedno wiązanie wodorowe w wodzie amoniakalnej miałoby być wyjątkiem?
Przez dziesiątki lat chemiczna społeczność całego świata wierzyła, że po rozpuszczeniu w wodzie amoniaku powstaje wodorotlenek amonu:
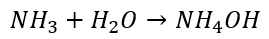
Miał on być słabo zdysocjowany w wodzie, czyli być słabym elektrolitem.
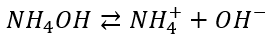
To by oznaczało, że istnieją cząsteczki o wzorze NH4OH, jednakże utworzenie pięciu wiązań jest poza fizycznymi możliwościami atomu azotu. Taki związek musiałbym mieć wyłącznie jonową strukturę, jak NaOH czy KOH, z tą różnicą, że zamiast jonów Na+ czy K+ byłyby tam jony NH4, czyli [NH4]+OH–. Ale taki związek byłby w wodzie mocnym elektrolitem, jak NaOH czy KOH, a czy tak jest? Ponadto jak ochładzamy roztwór NaOH czy KOH, to otrzymujemy hydraty NaOH lub KOH. Tymczasem ochładzając roztwór „wodorotlenku amonu” nie otrzymujemy kryształów o wzorze NH4OH·H2O i innych jego hydratów, tylko hydraty… Amoniaku, czyli NH3·H2O, albo NH3·0,5H2O.
Jednakże w wielu reakcjach woda amoniakalna zachowuje się tak, jakby była wodnym roztworem wodorotlenku amonu. Stąd zresztą nazwa: zasada amonowa – analogicznie jak zasada sodowa to wodny roztwór NaOH. Ot, dodając wodę amoniakalną do roztworu odpowiedniej soli strącamy wodorotlenki: Al(OH)3, Zn(OH)2, Ni(OH)2 – zupełnie tak samo, jak to robi zasada sodowa czy zasada potasowa…
Pierwsze dwa wodorotlenki są amfoteryczne. Powinny się roztworzyć w nadmiarze tej zasady amonowej. I Zn(OH)2 się roztwarza, ale przy Al(OH)3 czeka nas niespodzianka. Nie roztwarza się! Tymczasem zastąpienie „zasady amonowej” roztworem NaOH czy KOH – powoduje roztworzenie osadu Al(OH)3. Czy to jakiś „wyjątek”, jak nam lubią wmawiać w szkole? Nie, po prostu Zn(OH)2 w obecności wody amoniakalnej tworzy kompleksy:
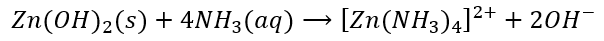
Ale przecież to nie są kompleksy z jonami OH-, tylko z cząsteczkami amoniaku – kolejny dowód na to, że woda amoniakalna to nie NH4OH(aq).
To dlaczego możemy za pomocą wody amoniakalnej strącić te wodorotlenki? Bo amoniak ulega w nieznacznym stopniu dysocjacji w wodzie zgodnie z równaniem:
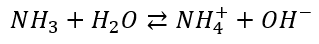
Ale czy pamiętamy o regule przekory? Usuwanie produktu reakcji przesuwa stan równowagi w prawo. A jony OH- mogą być wiązane przez kationy metali w praktycznie nierozpuszczalne wodorotlenki. To zmusza układ do wytworzenia nowych jonów OH-, czyli zwiększenia stopnia dysocjacji amoniaku. Ale wytworzenie kolejnej porcji jonów OH- skutkuje wytrąceniem kolejnej porcji wodorotlenku. A suma summarum: można za pomocą wody amoniakalnej wytrącić wiele wodorotlenków ilościowo – tak samo, jak za pomocą zasady sodowej czy potasowej.
Sumaryczne równanie reakcji chlorku glinu z wodą amoniakalną zapiszemy więc tak:
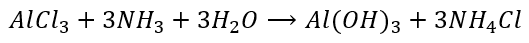
To samo otrzymamy, gdy zapiszemy w równaniu reakcji ten mityczny wodorotlenek amonu:
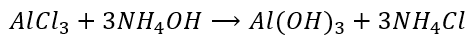
Zwróćmy uwagę, że para NH3 + H2O odpowiada jednej cząsteczce mitycznego NH4OH. Zwróćmy uwagę, że aby otrzymać NH4Cl to nie potrzebujemy rozpuszczać amoniaku w wodzie, żeby go najpierw przeprowadzić w „wodorotlenek amonu” a potem zobojętnić kwasem solnym. Gazowy amoniak reaguje wprost z gazowym chlorowodorem:
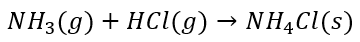
Zupełnie inaczej jest w przypadku strącania wodorotlenków. Tutaj woda bierze udział w reakcji, bo bez niej nie powstaną jony OH-, żeby owe wodorotlenki wytrącić. I być może o to autorowi pomysłu, żeby wodzie amoniakalnej przypisać wzór NH3·H2O. Żeby tej wody nie zgubić gdzieś w zapisywaniu równań. Żeby zawsze była gdzieś widoczna. I potem widzimy takie odrealnione równania reakcji:
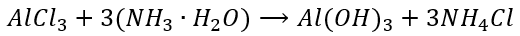
A przecież nie używaliśmy hydratu amoniaku, tylko roztworu amoniaku. Skoro w reakcji bierze udział woda, to nic nie stoi na przeszkodzie, by zamiast powyższej herezji napisać NH3 + H2O:
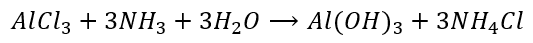
I jest to poprawniejsze, niż równanie poprzednie. Nie ma żadnych przeciwskazań ku temu, by przestać stosować nieprawny wzór wody amoniakalnej, która nie ma przecież żadnego ściśle ustalonego wzoru.
A teraz się zajmijmy się jakie błędy wynikają z zastąpienia jednej herezji nieco mniejszą herezją. Przyjmijmy więc, że wzór NH3·H2O jest wzorem wody amoniakalnej. Najpierw zerknijmy na zadanie nr 15 z maja 2019:

I teraz na odpowiedzi do niego:

Czy dostrzegamy, że pomimo, że „wzór wody amoniakalnej to NH3·H2O” jedna z zaliczanych odpowiedzi to ta, w której nie pojawia się wzór ten „wzór wody amoniakalnej”? Dlaczego? Bo to jest właściwa odpowiedź. Znacznie właściwsza, niż ta nad nią…
Ok, umówiliśmy się, że ten NH3·H2O oznacza wodę amoniakalną, czyli amoniak w fazie wodnej. To teraz popatrzmy na to zadanie z marca 2021:

I teraz odpowiedzi do niego:
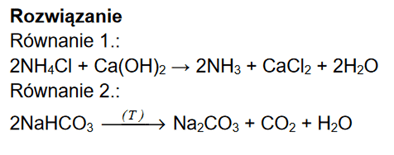
Chlorek amonu jest rozpuszczony w wodzie. Jednakże brakuje tutaj odpowiedzi, w której uwzględnimy „wzór wody amoniakalnej”:
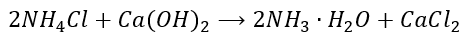
Dlaczego? Bo użycie tego wzoru tutaj wyklucza się z odzyskaniem amoniaku. Taka odpowiedź oznaczałaby, że otrzymaliśmy roztwór, który jako substancje rozpuszczone zawiera amoniak i CaCl2 – a przecież chcemy otrzymać amoniak, a nie jego roztwór. On musi ten roztwór opuszczać, a nie w nim pozostać. Przecież sami przyjęliśmy, że NH3·H2O to wzór wody amoniakalnej, a nie amoniaku. 😉
Zauważmy, że użycie tego wzoru nie zawsze jest dopuszczalne, bo może wykluczać się z możliwością zajścia pewnego procesu. Tymczasem jeśli po tej samej stronie równania pojawia się amoniak i woda – to zapisanie znaku „+” zamiast kropki pozbawia nas możliwości popełnienia tego błędu, nawet jeśli zapiszemy je obok siebie:


Powtarzam, że nie ma argumentów za tym, żeby błędnie stosować wzór krystalicznego adduktu amoniaku i wody jako wzór wody amoniakalnej. Jest dokładnie na odwrót – jest masa argumentów, by zaprzestać nauczania herezji, bo jest… herezją. To nie jest nawet uproszczenie. To po prostu herezja, przekłamanie.
Czy wodę amoniakalną powinno się nazywać zasadą amonową? Uważam, że nie, ponieważ nazwa ta wynika z błędnego przekonania o tym, że istnieje dobrze rozpuszczalny wodorotlenek amonu, a zatem jego wodny roztwór to zasada amonowa, analogicznie jak wodny roztwór NaOH to zasada sodowa. Tyle że z pary NH4OH i NaOH – istnieje tylko ten drugi.
Ok, rozpisałem się o tym mitycznym NH4OH, a ludzie napiszą maturę, pójdą na studia, do skostniałego i topornego na zmiany świata akademickiego i na zajęciach dostają butelki z takim podpisem.

Bo przecież po co coś zmieniać? Zawsze tak mieli napisane w instrukcjach opracowanych 50 lat temu i było dobrze… No i co z tego, że stężenie zwane normalnym też nie powinno być używane od jakichś 50 lat... A na butelce widzimy 2N.... I to jeszcze bez odstępu - 3 błędy na jednej etykiecie. Po co zmieniać? Tak jest w instrukcji do ćwiczeń napisane.
A potem znowu od jakiegoś studenta usłyszę, że w szkole mówili, ze na maturze nie można pisać NH4OH, bo on nie istnieje, a na studiach się dowiedział, że to nieprawda, bo ten związek istnieje... Ale nie chce mi się już strzępić klawiatury o tym.
A tymczasem już na początku lat 50-tych poprzedniego wieku wielu naukowców informowało, że NH4OH to XIX-wieczny mit.
Podsumowując: ani NH3·H2O, ani NH4OH, ani NH4OH(aq) to nie jest wzór wody amoniakalnej. Woda amoniakalna nie ma wzoru – możemy tylko doprecyzować, że interesujący nas składnik jest rozpuszczony w wodzie i napisać NH3(aq).
I tyle.