Pospolitym przypadkiem, wokół którego skupia się edukacja chemiczna, zarówno szkolna jak i akademicka, są reakcja odwracalne w układzie gaz-ciało stałe. Często zresztą czytam, że w wyrażeniu na stałą równowagi uwzględniamy gazy i ciecze, ale nie uwzględniamy ciał stałych. Nic bardziej błędnego! Albo co w przypadku takiej zagwozdki: „Czy jeśli w reakcji reagują ciecze i gazy to które należy wpisać do wyrażenia na stałą równowagi?”. Co byśmy odpowiedzieli? Edukacja, jak zwykle, kuleje i nie wyjaśnia dość prostych przypadków, które to właśnie powinna wyjaśniać. Bo od tego jest, ale wiemy, jak wygląda praktyka… W praktyce to zamiast budować bazę to serwuje się uczniom czy studentom nieistniejące „regułki”, które trudno wyplenić. W praktyce to ciągle spotykam stwierdzenie, że katalizator homogeniczny występuje w tym samym stanie skupienia co substraty, a heterogeniczny występuje w innym stanie skupienia niż substraty, co jest bzdurą – należałoby zapytać tego, kto powtarza tę „regułkę” co to znaczy homogeniczny i heterogeniczny. Ale wróćmy do równowagi chemicznej.
W poprzednich latach napisałem artykuł o stałej równowagi w układach niejednorodnych. Do tego artykułu mogę zresztą odesłać (kliknij tutaj). Ale jest rzeczą normalną, że dociekliwi ludzie zadają pytania i zresztą bardzo dobrze. Chcąc odpowiedzieć na ich zagwozdki i wątpliwości, napisałem jeszcze jeden artykuł, który traktuje o tym samym, ale opowiedziane w inny sposób i zawiera elementy nieporuszone wcześniej.
Bardzo tradycyjne jest w edukacji szkolnej rozpatrywanie przypadku reakcji w fazie gazowej, ale w układzie niejednorodnym: gdy jeden substrat jest ciałem stałym, a drugi jest w lotnym stanie skupienia. I tak to się jakoś ludziom utrwala, że to ciało stałe chodzi im po głowie. „Ciał stałych nie uwzględniamy w stałej równowagi”. No poniekąd prawda, co wyjaśniam we wcześniejszym artykule. Bo są tak naprawdę uwzględnione, tyle że anonimowo.
Gdybyśmy rozpatrzyli odwracalną reakcję rozkładu CaCO3:
CaCO3(s) ⇄ CaO(s) + CO2(g)
To stałą równowagi można tak zapisać:
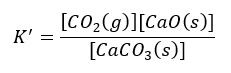
Jeśli CO2 przechowywać w pojemniku o stałej objętości, czyli o sztywnych (nierozciągliwych) ściankach, to stężenie gazowego CO2 możemy zmieniać wprowadzając większą masę CO2 do naczynia. Albo zmniejszać odpompowując go trochę z naczynia. CO2 zajmuje całą dostępną przestrzeń naczynia.
Ale co w przypadku CaCO3 albo CaO? W warunkach prowadzenia procesu są ciałami stałymi. Wrzućmy wapienny kamień (czyli CaCO3) do pudełka z pokrywką i zamknijmy – czy CaCO3 wypełni całe naczynie? Nie. Spadnie na dno pudełka. Jeśli wrzucimy kamień o masie 100 g (1 mol CaCO3) a pudełko ma 2 dm3 pojemności, to nie możemy powiedzieć, że stężenie CaCO3 wynosi 0,5 mol/dm3, bo:
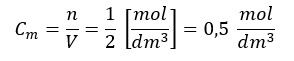
Bo czym jest stężenie molowe? Liczbą moli przypadającą na jednostkę objętości, tradycyjnie jest nią 1 litr (1 dm3). Celowo napisałem litr, bo spotykam nie takie rzadkie przypadki, że ludzie kończący swoją licealna przygodę z biolchemem nie wiedzą, że litr i dm3 to jest to samo… Tak więc edukacja szwankuje na wielu obszarach. Mol na decymetr sześcienny (mol/dm3) to inaczej mol na litr (mol/L) i zwłaszcza w literaturze akademickiej zamiast mol/dm3 spotyka się zapis mol/L. Ale mniejsza o to. CaCO3 nie rozproszył się po całym naczyniu. Spadł na dno. 100 g kalcytu ma objętość ok. 37 cm3. Stężenie CaCO3 możemy rozpatrywać tylko w kamieniu i wynosi ono:
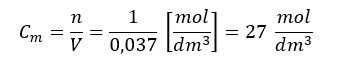
Jeśli wrzucimy drugi kamień o masie 100 g, to stężenie CaCO3 nie ulegnie zmianie. Będzie 200 g (2 mole) CaCO3, które zajmą objętość 74 cm3, czyli:
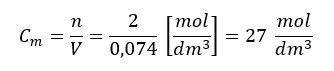
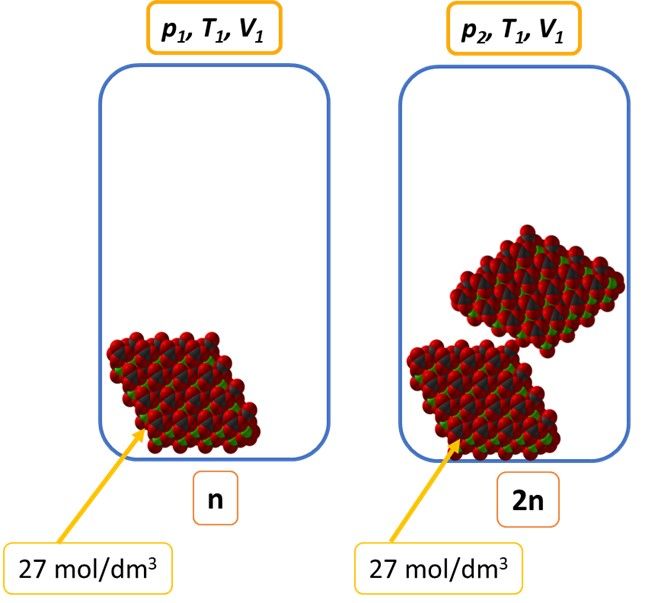
Stężenie ciała stałego w nim samym jest niezmienne, bo drobiny w nim są w całej objętości tak samo poukładane. Nie możemy zmienić stężenia CaCO3 w układzie dorzucając kolejnych kamieni do pudełka, bo nie rozproszą się one w całej objętości – wzrośnie masa, ale nie stężenie.
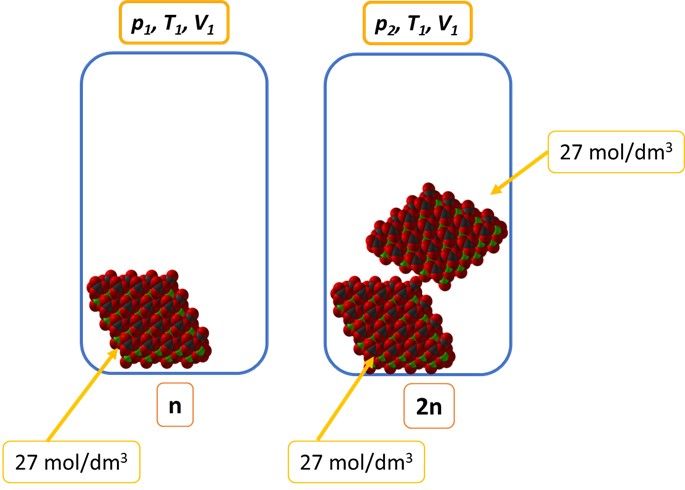
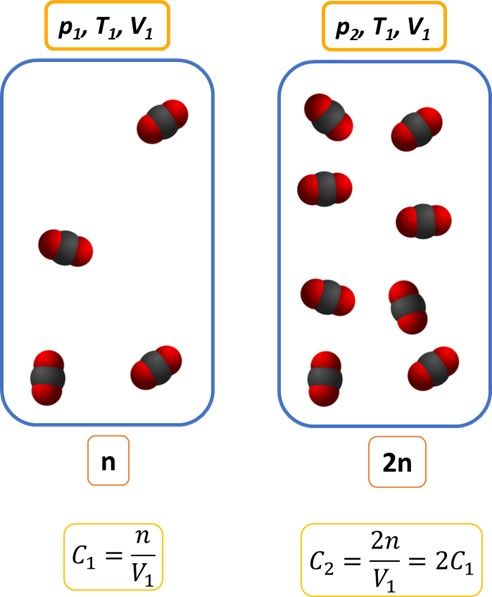
Analogicznie w przypadku CaO. A w przypadku CO2? Ten, ze względu na to, że jako gaz zajmuje całą objętość naczynia, to kolejne porcje wprowadzone do naczynia spowodują nie tylko wzrost jego masy, ale i stężenia… Stężenie to przecież nic innego jak zagęszczenie drobin. Nasz układ równowagowy prezentuje się tak:
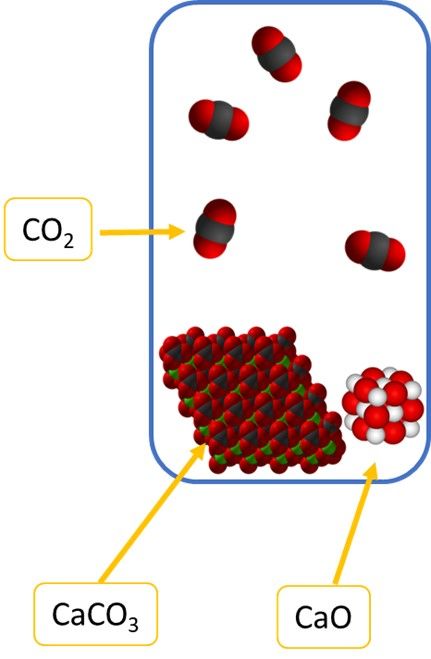
W wyrażeniu na stałą równowagi mamy więc dwa wyrazy stałe – stężenia CaCO3 i CaO – bo nie zależą one od ilości.
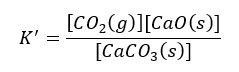
Wyrazy stałe możemy rozdzielić stronami od zmiennych:
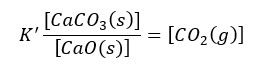
Ponieważ po lewej stronie mamy wyrażenia stałe, to po cała lewa strona ma wartość stałą i możemy ją zastąpić jednym symbolem K:
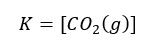
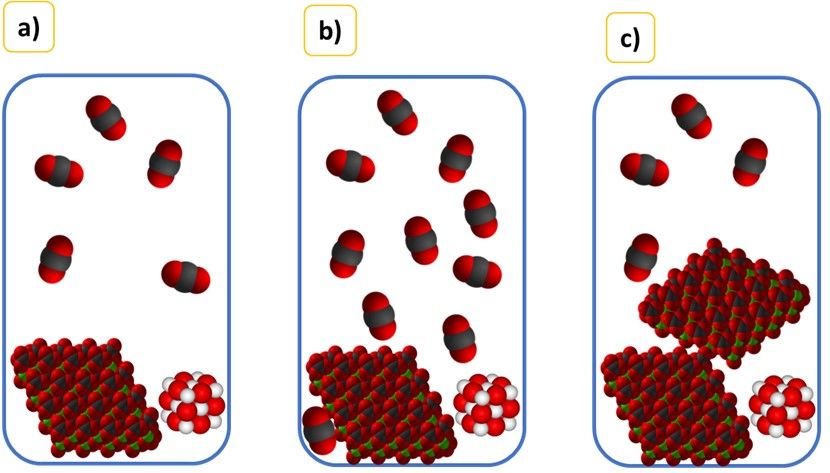
W tym przypadku równowagę procesu opisuje tylko stężenie CO2. A tak zachowa się układ, gdy zwiększymy w nim dwukrotnie masę CO2 (b), CaCO3 (c).
Ale układy niejednorodne to nie tylko reakcja typu gaz z ciałem stałym, ale także reakcje pomiędzy cieczą a gazem, cieczą a ciałem stałym czy pomiędzy dwoma cieczami nie mieszającymi się ze sobą.
Odpowiedź na to pytanie jest trochę bardziej skomplikowana niż w przypadku układu gaz - ciało stałe, który tutaj jest najprostszym przypadkiem. Ale gdy pojawiają się substancje ciekłe to sytuacja się komplikuje, bo możemy to dodatkowo podzielić na różne przypadki.
Przede wszystkim trzeba wziąć pod uwagę, czy w tej cieczy dobrze rozpuszczają się pozostałe składniki układu. Gdyż co innego, gdy produkt i substrat są ciekłe, ale praktycznie nie mieszają się ze sobą, a co innego, gdy się wzajemnie mieszają. Albo czy gazowy substrat się w cieczy rozpuszcza, czy też nie.
Na początek rozpatrzmy sobie równowagę reakcji żelaza z parą wodną.
3Fe + 4H2O ⇄ 4H2 + Fe3O4
W szkolnej praktyce rozpatrujemy sytuację, w której stałe żelazo reaguje z parą wodną i tworzy się gazowy wodór i kolejne ciało stałe, czyli tlenek żelaza(II) diżelaza(III). I rzeczywiście, gdyby tę reakcję przeprowadzać np. w temperaturze 800°C, to żelazo i jego tlenek są ciałami stałymi. A zatem równanie reakcji zapiszemy w tym przypadku tak:
3Fe(s) + 4H2O(g) ⇄ 4H2(g) + Fe3O4(s)
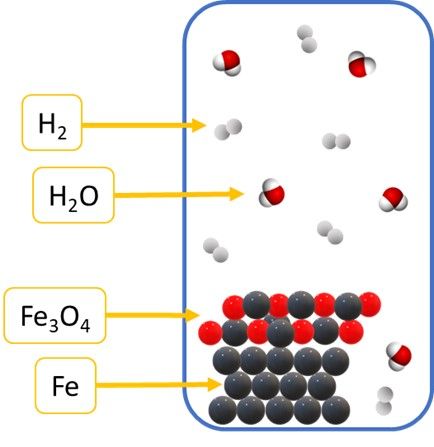
Możemy w reaktorze zmieniać stężenie pary wodnej, wodoru, ale nie Fe i nie Fe3O4… A wyrażenie na stężeniową stałą równowagi zapiszemy tak:
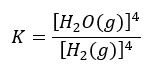
I wszystko proste: dwa ciała stałe, dwie substancje w gazowym stanie skupienia - typowy przypadek szkolny, czy ewentualnie na studiach.
No dobrze, zaczęliśmy od 800 °C, ale co się stanie, jak zaczniemy badać wpływ temperatury na równowagę tego procesu i podniesiemy temperaturę o 1000 °C? To znaczy, że ogrzejemy nasz reaktor z 800 do 1800 °C. W tak wysokiej temperaturze zarówno żelazo, jak i jego tlenek są cieczami: w reaktorze mamy więc ciekłe (stopione) żelazo i ciekły (stopiony) Fe3O4. A to znaczy, że powyższe równanie reakcji zmodyfikujemy do postaci:
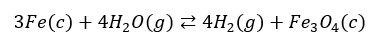
Układ nadal jest niejednorodny, ale zamiast ciał z całych mamy teraz dwie ciecze, tzn. dwa gazy i dwie ciecze. Mamy tutaj układ dwóch nie mieszających się cieczy, ale gdyby obniżyć temperaturę z 1800 do 800 °C, to znowu byśmy wrócili do naszego punktu wejścia, bo mielibyśmy dwa ciała stałe i dwa gazy.
No dobrze, rozpatrzmy teraz jak to się ma do powtarzanej na szkolnych korytarzach „regułki”, że w stałej równowagi uwzględniamy gazy i ciecze. Czy więc wyrażenie na stałą równowagi zapiszemy tak:
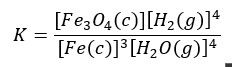
Zastanówmy się, co się stanie, gdyby w tym układzie zwiększyć masę ciekłego żelaza. Czy wpłynie to na jego stężenie w układzie? Czy po prostu poleci na dno, jak rtęć wlana do probówki? Raczej ta druga opcja. Tak samo, gdy zwiększymy masę Fe3O4… Nie zmienimy stężenia tych substancji w układzie. A zatem uwzględniając, że stężenie żelaza w żelazie i tlenku w tlenku jest stałe, otrzymujemy to samo wyrażenie na stałą równowagi:
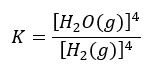
Zwróćmy uwagę, że nie ma znaczenia, który z tych 2 przypadków rozpatrujemy. W obu przypadkach możemy zmienić stężenie wodoru albo pary wodnej. Ale nie możemy zmienić stężenia żelaza czy jego tlenku – i nie ma znaczenia, czy Fe i Fe3O4 są ciałami stałymi, czy cieczami. Ważne, że stanowią osobne fazy i nie można zmienić ich stężenia w tych fazach. Nie uwzględniamy stężenia Fe i Fe3O4 nawet wtedy, gdy są cieczami. Bo nie o to chodzi, czy są cieczami, czy ciałami, tylko o to, czy układ reakcyjny jest jednorodny. Czy wszystkie składniki są zmieszane ze sobą, czy też stanowią osobne fazy w warunkach prowadzenia procesu. W naszym przypadku mamy układ heterogeniczny, czyli niejednorodny, albo inaczej wielofazowy. Przeciwieństwem byłby układ homogeniczny (jednorodny), czyli jednofazowy – wtedy wszystkie składniki byłyby ze sobą wymieszane, a ich stężenie możnaby zmieniać.
Możemy rozpatrzyć jeszcze trzecią możliwość – przeprowadzenie tej reakcji w temperaturze pomiędzy 1538 a 1598 °C. Gdyby reaktor ogrzać z 800 do 1550 °C, to żelazo ulegnie stopieniu, ale jego tlenek jeszcze będzie ciałem stałym.
3Fe(c) + 4H2O(g) ⇄ 4H2(g) + Fe3O4(s)
Czy to coś zmienia? Nie. Nadal mamy:
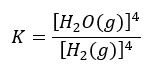
Bo nie chodzi o stan skupienia, tylko o liczbę faz, czyli jednorodność, lub niejednorodność układu. Analogiczną sytuację mamy w przypadku rozkładu tlenku rtęci(II).
2HgO(s) ⇄ 2Hg(c) + O2(g)
W tym konkretnym przypadku wyrażenie na stałą równowagi przyjmie postać:
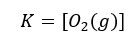
Mam na myśli ten konkretny przypadek, gdy rtęć występuje w ciekłym stanie skupienia, czyli przeprowadzenie tej reakcji w takich warunkach, w których rtęć jest cieczą. Wtedy rtęć się skrapla i kropelki rtęci pojawiają się np. na ściankach naczynia. Ale czy trzeba akurat się do tego ograniczać? Niekoniecznie, gdyż można przeprowadzić tę reakcje w takich warunkach, w których rtęć będzie wyłącznie w stanie pary w układzie. A wtedy lekko zmodyfikujemy nasze równanie reakcji oraz… Wyrażenie na stałą równowagi.
2HgO(s) ⇄ 2Hg(g) + O2(g)
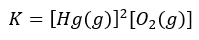
Właśnie w tym przypadku pary rtęci zostały już uwzględnione w wyrażeniu na stałą równowagi. A wynika to stąd, że teraz ich stężenie to jest parametr zmienny – możemy zmieniać stężenie par rtęci. I co w tej konkretnej sytuacji? Równowaga tej reakcji jest uzależniona od ilości rtęci w układzie. Ale to tylko dlatego, że ich stężenie jest teraz parametrem, który można zmieniać zmieniając jej masę. Dla osób zainteresowanych jeszcze kilka informacji na samym końcu o tym i jemu podobnych przypadkach.
No dobrze, a jak to ma się do tego, co jest często powtarzane w szkołach, że w stałej równowagi uwzględniamy gazy i ciecze? Cały czas dążę do tego, by pokazać, że gdzieś zatracono sens. Że powtarzane są rzeczy nie mające właściwie sensu.
Jeśli w temperaturze pokojowej badać równowagę reakcji pomiędzy etanolem a kwasem octowym, to rzeczywiście obydwa substraty są ciekłe. Ale nie chodzi o to, że są ciekłe, tylko o to, że mieszają się ze sobą: tworzą układ jednorodny, czyli roztwór. A jeśli tworzą roztwór, to można zmieniać stężenia poszczególnych składników zmieniając stosunek, w którym są zmieszane. To znaczy inne będzie stężenie etanolu w mieszaninie reakcyjnej, gdy zmieszać 1 mol etanolu i 1 mol kwasu octowego, a inne, gdy zmieszać 1 mol etanolu i 2 mole kwasu octowego. Powstający octan etylu i woda tworzą z kwasem octowym i etanolem mieszaninę jednorodną, czyli roztwór. Stężenia wszystkich reagentów są więc parametrem zmiennym, wobec czego wszystkie je uwzględniamy w wyrażeniu na stałą równowagi.
Ponadto reakcję estryfikacji możemy przeprowadzić w obojętnym rozpuszczalniku takim jak toluen. W tej sytuacji także możemy zmieniać stężenia substratów. I ponownie uwzględniamy wszystkie reagenty w wyrażeniu na stałą równowagi reakcji.
I ponownie nie chodzi o to, że reagenty są cieczami, tylko o to, że tworzą układ jednorodny, a przez to ich stężenie jest zmienne.
Rozpatrzmy sobie jeszcze jeden ciekawy przypadek. Załóżmy, że badamy równowagę reakcji hydratacji etenu w temperaturze pokojowej. Normalnie taką reakcję prowadzi w podniesionych temperaturach, w których wszystkie składniki są w fazie lotnej, ale w rozpatrywanym przypadku woda jest cieczą, a eten jest gazem. Eten jest praktycznie nierozpuszczalny w wodzie: otrzymujemy więc układ dwufazowy, czyli niejednorodny.
Możemy więc sobie wyobrazić układ reakcyjny, w którym dolną część naczynia stanowi ciecz (woda z dodatkiem H2SO4, który katalizuje tę reakcję), a nad fazą ciekłą znajduje się gaz (eten).
„W stałej równowagi uwzględniamy gazy i ciecze” - ale po raz kolejny przekonamy się, że zdanie to bywa bardzo zdradliwe. W naszym przypadku mamy i ciecz, i gaz, tylko problem w tym, że nie utworzyły jednorodnego układu. Dodatek cieczy nie wpływa na stężenie wody w układzie. A stężenie etenu możemy zmieniać.
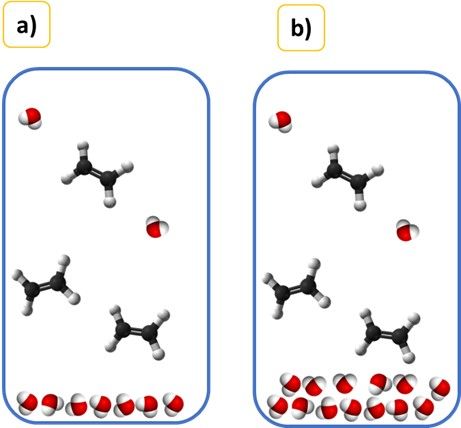
Dobra, jeszcze jeden przypadek estryfikacji kwasu salicylowego z etanolem.
HOC6H4COOH + C2H5OH ⇄ HOC6H4COOC2H5 + H2O
Reakcję tę prowadzi się we wrzącym rozpuszczalniku, który stanowi etanol użyty w dużym nadmiarze. Pod normalnym ciśnieniem, przy którym wykonuje się zazwyczaj tę reakcję etanol wrze w 78°C. A kwas salicylowy topi się dopiero w temperaturze powyżej 159°C. Zatem w temperaturze wrzenia etanolu jest to ciało stałe. Czy to oznacza, że wyrażenie na stałą równowagi tej estryfikacji zapiszemy tak:
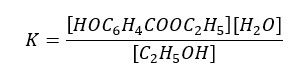
Nie! Zapiszemy ją uwzględniając stężenie kwasu salicylowego:
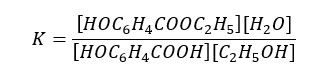
Bo nie ma znaczenia, że kwas salicylowy jest ciałem stałym. Ważne jest, w jakiej postaci występuje w układzie reakcyjnym. Kwas salicylowy dobrze rozpuszcza się w etanolu, a zatem ciała stałego w naszym układzie reakcyjnym nie będzie, będzie roztwór.
HOC6H4COOH(roztw.) + C2H5OH(roztw.) ⇄ HOC6H4COOC2H5(roztw.)
+ H2O(roztw.)
Skoro kwas salicylowy jest w roztworze, to jego stężenie ulega zmianom podczas reakcji, a możemy je sami zmieniać dodając kwasu salicylowego do układu. Nie dajmy się zwieść temu, że kwas salicylowy jest ciałem stałym warunkach, których prowadzi się reakcję. Nie możemy zapominać, że oprócz temperatury i ciśnienia mamy jeszcze w układzie etanol, czyli rozpuszczalnik dla kwasu salicylowego. Czyli jest to ten sam układu reakcyjnego, co w przypadku etanolu i kwasu octowego, w którym mamy „dwie ciecze”. A tak właściwie to mamy jedną ciecz: roztwór reakcyjny. I to zarówno w przypadku estryfikacji kwasu octowego z etanolem, jak i w przypadku estryfikacji kwasu salicylowego z etanolem.
Taki przypadek badania równowagi reakcji etenu z wodą w temperaturze pokojowej jest jednak jeszcze bardziej skomplikowany. Sytuacja komplikuje się, gdy w cieczy rozpuszcza się któryś substrat lub produkt. W tym przypadku powstający etanol może być absorbowany przez fazę wodną.
Tak samo wodorowęglan amonu łatwo rozkłada się nawet w temperaturze pokojowej.
NH4HCO3(s) ⇄ NH3(g) + CO2(g) + H2O(c)
Pozostawiony w nieszczelnie zamkniętym naczyniu wkrótce zaczyna pływać w jakiejś cieczy. To woda powstająca podczas rozkładu, która jako ciecz rozpuszcza w sobie NH4HCO3, ale także pozostałe produkty rozkładu (głównie NH3), co komplikuje sprawę. Ale na razie nie zaprzątajmy sobie tym głowy.
Wszystkie dotychczasowe wyprowadzenia są słuszne pod warunkiem, że faza stała lub ciekła zajmuje nieznaczną objętość reaktora. I nawet gdy wprowadzamy większą ilość cieczy lub ciała stałego do reaktora, to jej objętość nadal pozostaje nieznaczna w stosunku do objętości reaktora. To znaczy, że objętość dostępna dla gazu praktycznie się nie zmienia. Jeśli nasz reaktor ma pojemność 10 dm3 wrzucimy do niego kamyk wapienny o objętości 40 cm3 (0,04 dm3), to dla gazu przypada 9,96 dm3 dostępnej przestrzeni. Gdybyśmy następnie wrzucili kolejny kamyk o takiej samej objętości, to dla gazu przypada 9,92 dm3 dostępnej przestrzeni. Praktycznie tyle samo (zmiana o ok. 0,4% i o tyle samo zmieni się stężenie – czyli jest praktycznie stałe). Ale gdybyśmy wprowadzili do reaktora dodatkowo 5 kg węglanu wapnia to przestrzeń dostępna dla gazu zdecydowanie się zmniejszy – z 9,96 do 8,10 dm3. A skoro tak to znaczy, że w reaktorze wzrośnie ciśnienie, jak widać na obrazkach a) i b), na których widać, że wprowadzenie dodatkowo dużej ilości CaCO3 zdecydowanie zwiększa ciśnienie CO2, a więc wytrąca układ z równowagi.
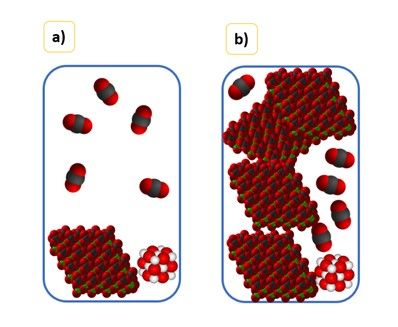
A czym poskutkuje wzrost ciśnienia CO2 w układzie CaCO3-CaO-CO2? Zgodnie z regułą przekory obniżeniem ciśnienia, a zatem część CO2 przereaguje z tlenkiem wapnia i… Odtworzy CaCO3. Czyli choć dodatek CaCO3 nie zmienia jego stężenia, to jednak zmienia stężenie CO2… A stężenie CO2 ma istotny wpływ na stan równowagi tej reakcji. Przy niezmienionej temperaturze po nawrzucaniu kamieni i po powtórnym osiągnięciu stanu równowagi ciśnienie w układzie powróci do początkowej wartości. Ale cząsteczek CO2 będzie mniej, jak i masa CaO będzie mniejsza.
Dodatkowy komentarz
Jak wspomniałem reakcje rozkładu tlenku rtęci można przeprowadzić tak, by w tej samej temperaturze stan równowagi zależał lub nie zależał od ilości rtęci w układzie. Skąd takie dwojakie zachowanie? Nie poruszyliśmy jeszcze jednej istotnej kwestii. Tego, że parę można skroplić. Podobnie jak roztwory dzielimy na nienasycone, nasycone i przesycone, tak samo pary dzielimy na nienasycone, nasycone i przesycone. W zamkniętym układzie ciecz nie paruje w nieskończoność, tylko do momentu nasycenia dostępnej przestrzeni parą. Stężenie pary osiąga więc jakąś graniczną wartość – stężenie równowagowe. W przypadku gazów miarą stężenia jest ciśnienie, bo są to wielkości proporcjonalne. A zatem nasycenie otoczenia parą możemy określać poprzez jej ciśnienie jako odpowiednik stężenia. Równowagowe ciśnienie pary nazywamy ciśnieniem pary nasyconej lub inaczej prężnością pary nasyconej. Woda w temperaturze 100 °C wytwarza parę o ciśnieniu 1013 hPa, co odpowiada stężeniu 0,0327 mol/dm3. W temperaturze 100 °C w pojemniku o pojemności 10 dm3 może znajdować się więc 0,327 mol pary wodnej. Jeśli w temperaturze 100 °C do pojemnika z próżnią o pojemności 10 dm3 Wprowadzić 1/10 mola wody (ciekłej), to cała woda odparuje, a stężenie wody (jako pary) osiągnie wartość, 1/100 mola/dm3. Jeśli wprowadzić kolejną porcję 1/10 mola wody, to ta porcja też odparuje i stężenie osiągnie wartość 0,02 mol/dm3. Gdy wprowadzi 3 identyczną porcję to otrzymamy 0,03 mol/dm3, bo cała ciecz odparuje. Ale gdy wprowadzimy 4 porcję, to odparuje tylko tyle, ile potrzeba by nasycić układ i osiągnąć stężenie 0,327 mol/dm3. Reszta wody pozostanie na dnie, bo przestrzeń nad cieczą wysyciła się parą wodną. Wprowadzanie kolejnych porcji cieczy nie skutkuje odparowaniem wody. Zwiększa się za to masa cieczy na dnie. Zwróćmy uwagę na to, że ciecz nie mogła istnieć w naczyniu, póki stężenie pary nie osiągnęło równowagowej wartości 0,0327 mol/dm3 (co odpowiada ciśnieniu 1013 hPa). W temperaturze 100°C w naczyniu o pojemności 10 dm3 można przeprowadzić w stan pary prawie 6 g wody. Co to oznacza? Że w temperaturze 100°C można zmieniać stężenie wody w zakresie od zera do 0,327 mol/dm3, albo można zmieniać ciśnienie pary wodnej pomiędzy zero a 1013 hPa. W tym zakresie stężenie wody (jako pary) może się zmieniać. Na przykład gdybyśmy badali równowagę reakcji hydratacji etenu w fazie gazowej w temperaturze 100°C, to możemy przesuwać stan równowagi reakcji w prawo dodając do układu wody, do momentu, aż jej stężenie pary nie osiągnie granicznej wartości.
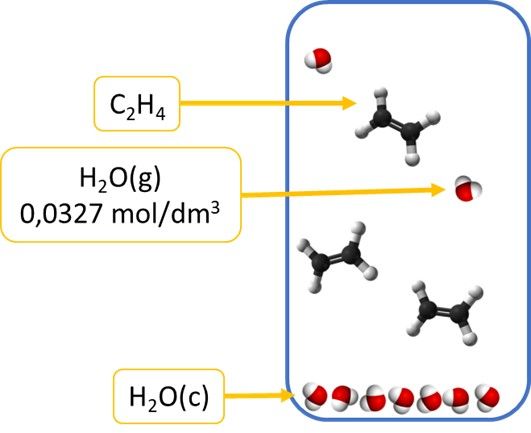
W tym momencie dalsze wprowadzanie wody nie poskutkuje wzrostem jej stężenia, bo spłynie ona na dno. I układ z homogenicznego stanie się heterogeniczny. A w układzie heterogenicznym dodawanie wody nie powoduje zmiany jej stężenia. Oczywiście jeśli objętość fazy ciekłej zajmuje nieznaczną część objętości reaktora, bo gdy przeholujemy z jej ilością, to zmienimy ciśnienie gazów…