Przyjrzyjmy się kolejnemu zadaniu:

Wg autorskiej odpowiedzi:
Rozkład CaC2O4 wg podanego równania reakcji jest niemożliwy. Wynika to faktu, że szczawian wapnia rozkłada się do węglanu wapnia wg równania:
CaC2O4 → CaCO3(s) + CO
Rozkład taki zachodzi w temperaturze powyżej 400 °C. Ogrzewanie powstałego CaCO3 do temperatur powyżej 600 °C powoduje jego rozkład na tlenki:
CaCO3(s) → CaO(s) + CO2(g)
Wyobraźmy sobie, że w komorze grzewczej termograwimetru umieszczamy w osobnych naczyniach szczawian wapnia i kalcyt (CaCO3). Następnie rozpoczynamy ogrzewanie. Najpierw dochodzimy do temperatury 400 °C i masa naczynia z CaC2O4 spada. W tej temperaturze masa naczynia z CaCO3 się nie zmienia. Temperatura rośnie nadal, cały szczawian wapnia zdążył się rozłożyć już na CaCO3 zanim temperatura osiągnęła wartość 600 °C. Teraz dopiero następuje rozkład CaCO3 - maleje masa obu naczyń. Nawet na Wikipedii znajdziemy termogram rozkładu CaC2O4 na potwierdzenie tego. Z tą różnicą, że materiałem startowym jest hydrat CaC2O4·H2O:
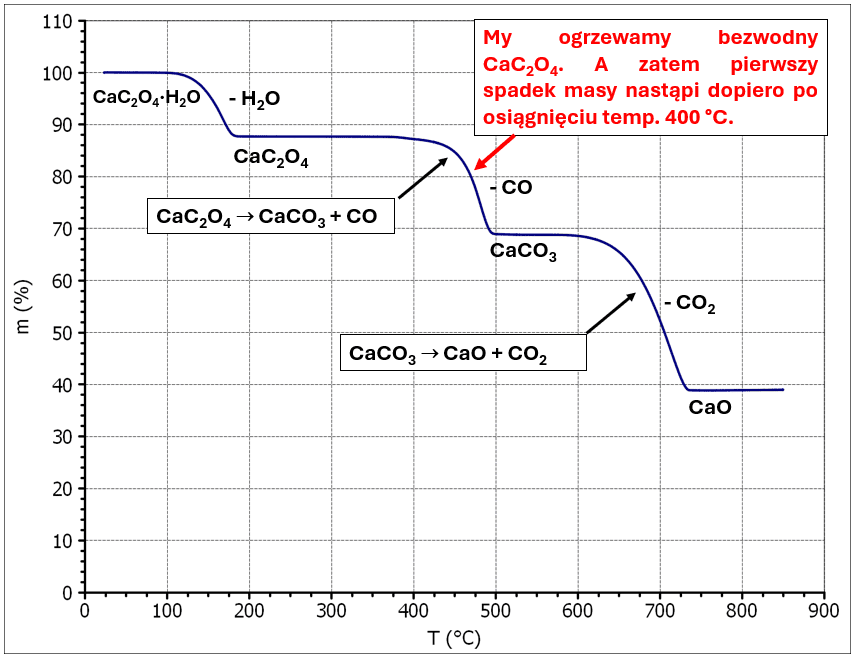
Ponieważ CaCO3 ma większą stabilność termiczną, to nie możliwości by oba procesy (rozkładu szczawianu i rozkładu kalcytu) biegły równocześnie i to taką szybkością, by powstający CaCO3 na bieżąco rozkładał się na CaO i CO2 - a właśnie taką sytuację można by opisać jednym równaniem reakcji:
CaC2O4(s) → CaO(s) + CO2(g) + CO(g)
Nie jest więc możliwe, by ogrzewana próbka zawierała jedynie CaC2O4 i CaO. Najpierw będzie powstawał wyłącznie CaCO3, więc otrzymujemy mieszaninę CaC2O4 z CaCO3.
Rozkład wg podanego równania reakcji byłby możliwy tylko wtedy, gdyby CaC2O4 był bardziej stabilny termicznie niż CaCO3. Czyli musiałoby być na odwrót, np. CaCO3 rozkładałby się już w 400 °C, a CaC2O4 dopiero powyżej 600 °C. Wyobraźmy sobie, jakby to wyglądało: w komorze grzewczej termograwimetru umieszczamy w osobnych naczyniach szczawian wapnia i kalcyt (CaCO3). Następnie rozpoczynamy ogrzewanie. Najpierw dochodzimy do temperatury 400 °C i masa naczynia z CaCO3 spada. Masa naczynia z CaC2O4 się nie zmienia. Temperatura rośnie nadal, cały węglan wapnia zdążył się rozłożyć na CaO zanim temperatura osiągnęła wartość 600 °C i masa naczynia z CaO się już nie zmienia. Teraz dopiero następuje rozkład CaC2O4 - maleje masa drugiego naczynia. Ale w temperaturze 600 °C nie istniałby już CaCO3.... A zatem CaCO3 powstający z rozkładu szczawianu od razu rozkładałby się na CO2 i CaO, bo byłby poza zakresem swojego istnienia. I bilans stechiometryczny zamknąłby się w równaniu sumarycznym podanym w zadaniu i otrzymalibyśmy mieszaninę CaC2O4 z CaO.
Ale tak by było, gdyby CaCO3 rozkładał się w niższej temperaturze niż CaC2O4. A tak nie jest.
Co ciekawe, to zadanie pochodzi ze zbioru obejmującego zadania z matury w roku 2020. Zobaczmy więc na inne zadanie, z którym w 2020 roku mierzyli się maturzyści. I zwróćmy uwagę na podkreślony fragment zdania:

A zatem oba zadania znajdują się w tym samym zbiorze. Czy widzimy brak spójności pomiędzy tymi zadaniami? Jeśli próbka zawiera CaO, to nie zawiera CaC2O4 - bo zasadniczo nie może go wtedy już zawierać.
Czy równanie podane w zadaniu:
CaC2O4 → CaO + CO2 + CO
zupełnie nie ma sensu? Ma, ale tylko po jednym warunkiem. Że przedstawia ono bilans stechiometryczny w którym pokazujemy stan początkowy i stan końcowy, gdy jedyną substancją stałą w próbce był już CaO. Wtedy z 1 mola szczawianu wapnia po ogrzewaniu próbki do temperatur ponad 600 °C tak długo, aż jej masa przestanie się zmieniać (tzn, że cały CaCO3 rozłożył się już na CaO) otrzymamy 1 mol CaO, 1 mol CO i 1 mol CO2. I to równaniu wyrażałoby jedynie sumaryczny bilans tego procesu.