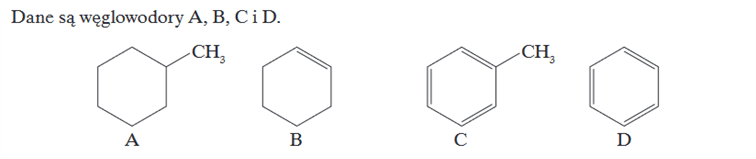
Wyobraźmy sobie sytuację:
Przyglądamy się budowie tlenku wapnia i siarczku baru:
CaO: jony Ca2+ i O2-
BaS: jony Ba2+ i S2-
Dodatkowo załóżmy, że znamy tylko metale II grupy i niemetale grupy XVI. Bo tyle od nas wymagają to tyle znamy. Analizując budowę tych dwóch związków wyciągamy wniosek:
Metale tym się różnią od niemetali, że metale tworzą dwudodatnie kationy, a niemetale dwuujemne aniony.
Czy ten wniosek jest słuszny? Nie. Popatrzy np. na takie metale jak litowce, albo na takie niemetale jak fluorowce. Popatrzmy na takie kationy jak Fe3+, Cr3+ itp.
To, że czegoś nie znamy, bo nie musimy - nie upoważnia nikogo do wyciągania zbyt ogólnych wniosków. Do czynienia z czegoś reguły itd. Równie dobrze patrząc na trójkąt o bokach równych 3 cm, 4 cm i 5 cm, który jest prostokątny oczywiście, możemy powiedzieć, że trójkąt prostokątny charakteryzuje się tym, że długości boków mają się do siebie w stosunku 3 : 4 : 5. Zawsze? Nie, to dotyczy tylko trójkąta egipskiego. Nie widziałem innych trójkątów prostokątnych nie oznacza, że wyciągnąłem poprawny wniosek.
Wracamy do chemii.
Zainteresowały mnie 2 przypadki. Zerknijmy na to zadanie:


I oryginalną odpowiedź do niego:

Problem w tym, że odpowiedź ta jest nieprawidłowa. Dlaczego? Kluczem jest słowo „wyłącznie”.
Czy związek A reaguje z bromem wyłącznie w obecności światła? Spróbujmy sobie odpowiedzieć na pytanie: a po jest tej reakcji potrzebne światło?
Światło jest formą energii. Dostarcza do układu reakcyjnego energii, która rozbija niektóre cząsteczki bromu lub chloru na atomy. Atomy bromu i chloru mają po 1 niesparowanym elektronie, czyli są rodnikami. Ale żeby rozbić cząsteczki na rodniki wystarczy też podnieść temperaturę – to też dostarcza przecież energii. A zatem:
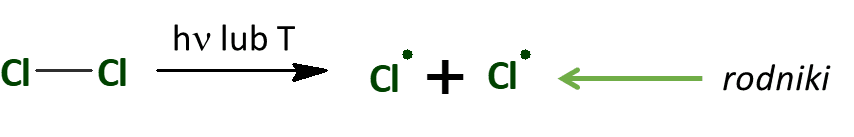
Tak więc takie chlorowanie metanu można przeprowadzić w wysokiej temperaturze, zamiast na świetle.
Przyjrzyjmy się kolejnym etapom chlorowania metanu:
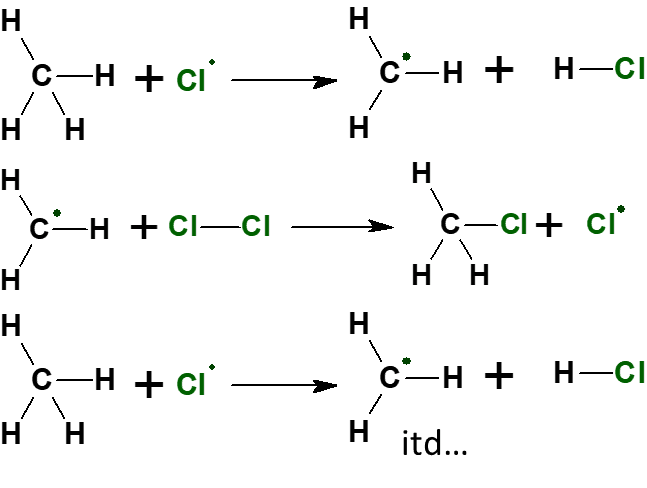
Szczególną uwagę zwróćmy na tę reakcję elementarną:
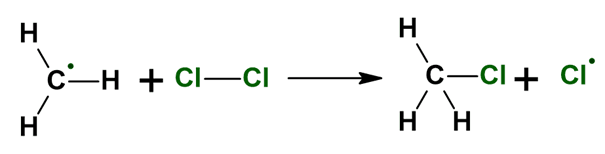
Rodnik także reaguje z cząsteczką fluorowca i powoduje powstanie nowego rodnika. Reakcja ma charakter łańcuchowy, więc jeden wygenerowany rodnik może doprowadzić do powstania wielu cząsteczek produktów, zanim zdąży zaniknąć w reakcjach terminacji, np. takich:
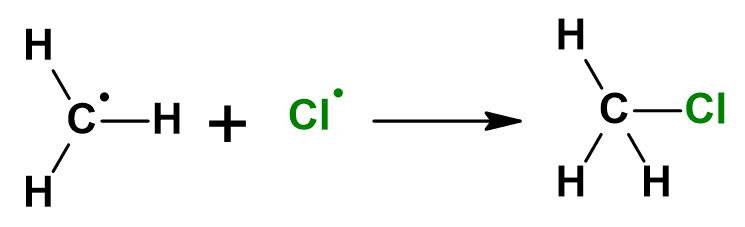
No dobrze, światło umożliwia wygenerowanie rodników Cl* lub Br*. A co, jeśli do układu reakcyjnego wprowadzimy jakieś rodniki? One także będą reagować z cząsteczkami chloru lub bromu… Czyli wygenerują rodniki, które następnie zaczną reagować z cząsteczkami metanu. Nie musimy więc naświetlać, albo porządnie przygrzać – wystarczy, że dodamy tam niewielką ilość substancji, która łatwo rozpada się na rodniki. Jednym z najprostszych związków mogących rozpadać się na rodniki jest nadtlenek wodoru. Jedna cząsteczka H2O2 może rozpaść się na dwa rodniki hydroksylowe *OH.
Jest wiele związków, których używa się jako inicjatory rodnikowych reakcji. Należą tu zarówno związki jonowe jak i kowalencyjne, przykładem jonowego jest K2S2O8 – peroksydisiarczan potasu:
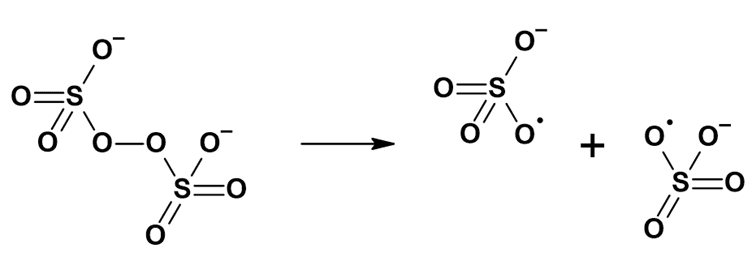
W temperaturze powyżej pokojowej związek ten rozpada się na rodniki, które inicjują właściwą reakcję. Do częściej używanych należą rozpuszczalne w organicznych cieczach nadtlenki i wodoronadtlenki organiczne, związki z ugrupowaniem diazenowym (azowym) -N=N-, gdzie sztandarowym przykładem jest tzw. azo(bisizobutyronitryl) (AIBN), rozpadający się wg równania reakcji:
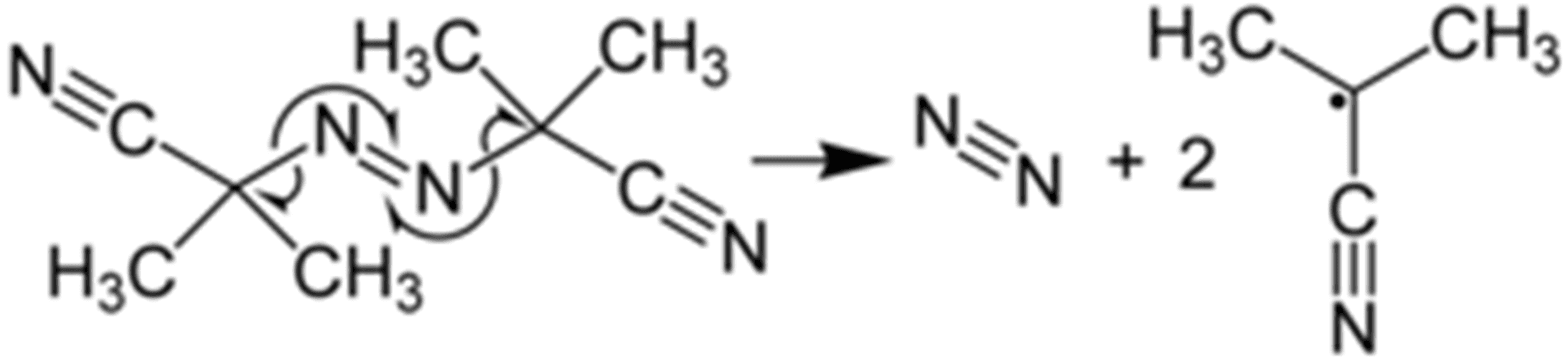
Ukradłem z Wikipedii, bo jestem zbyt leniwy, żeby to samemu rysować. UWAGA! Nie myl temperatury podniesionej/powyżej pokojowej z wysoka temperaturą. Jest różnica czy mamy na myśli 50 °C, czy 500 °C…
Ogólnie związki takie nazywamy INICJATORAMI. Do inicjatorów zaliczamy także światło (widzialne lub częściej ultrafiolet).
Inicjatorów nie należy mylić z katalizatorami! Inicjatory, choć ich zastosowanie przyspiesza reakcję i umożliwia przeprowadzenie jej w znacznie niższych temperaturach, np. w 50 zamiast 500 °C, to nie są katalizatorami. Ta druga opcja temperatury w wielu przypadkach zresztą nie prowadzi do oczekiwanych rezultatów w przypadku związków organicznych.
Tak więc są katalizatory i są inicjatory, a reakcje dzielimy na katalizowane i na reakcje inicjowane. Inicjatory nie odtwarzają się.
Wracając do zadania: taki licealista szykujący się do matury z chemii nie musi o tym wiedzieć. Ale musi być świadomy tego, że będzie rozliczony z odpowiedzi, w którą sam się wpakuje. Jeśli więc napisze tak:
„Związek A ulega reakcji z bromem w obecności światła” – to będzie dobrze, bo to jest prawda.
„Związek A ulega reakcji z bromem wyłącznie w obecności światła” – to będzie źle, bo to NIE jest prawda.
Nie muszę znać nie oznacza, że mogę pisać nieprawdę. Maturzysta jest oceniany z poprawności swojej odpowiedzi.
No dobrze, maturzysta może o pewnych rzeczach nie wiedzieć, ale nic nie usprawiedliwia zadań, które wprowadzają ludzi w błąd – nie tylko maturzystów.
A światło nie ma wyłączności na inicjowanie reakcji związku A z bromem.
Co do benzenu, czyli związku D – katalizatory nie mają wyłączności na przyspieszanie reakcji benzenu z bromem. Podczas długotrwałego i mocnego naświetlania dojdzie do addycji bromu lub chloru do benzenu, jak do wiązania podwójnego. W warunkach probówkowych nie zaobserwujemy jednak odbarwienia układu tak jak ma to miejsce w przypadku reakcji alkanów z bromem na świetle, gdzie wystarczy 1-2 minuty na słoneczku.

Po prawej stronie mamy benzen na wodą bromową. Zwróćmy uwagę, że warstwa n-pentanu (trzecia probówka) się odbarwiła. Reszki bromu są jeszcze w fazie wodnej (dolnej), ale ich chwile są policzone. Natomiast warstwa benzenu nie zamierza stać się bezbarwna.
A teraz zerkniemy jeszcze na to zadanie. Czy domyślacie sie, jaka jest oryginalna odpowiedź do niego? Tak, że to fałsz. Tymczasem nie jest konieczne - można uzyć innego inicjatora.

PS a co do prawdziwej matury - nie przejmujcie się tym aż tak bardzo - zadanie będzie tak sformułowane, żeby nie było niejasności, ani gdybania.