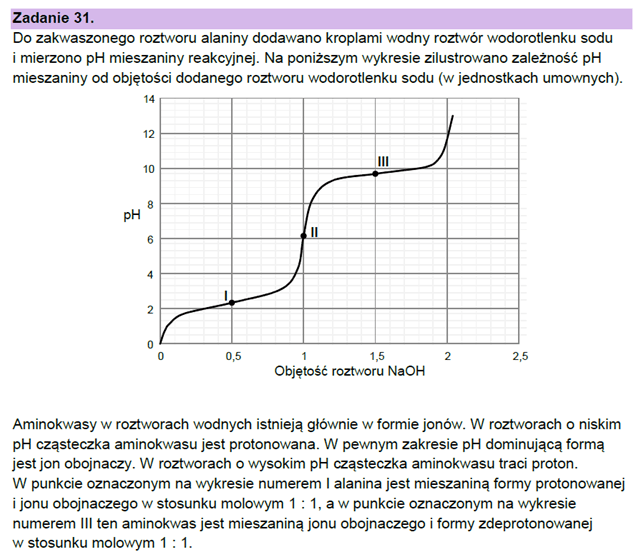
Najpierw przyjrzyjmy się zadaniu 31 z maja 2023. To zadanie skonstruowane jest poprawnie i odpowiedź do niego także jest poprawna!

Ale już odpowiedź do zadania z czerwca 2019 zawiera błąd:
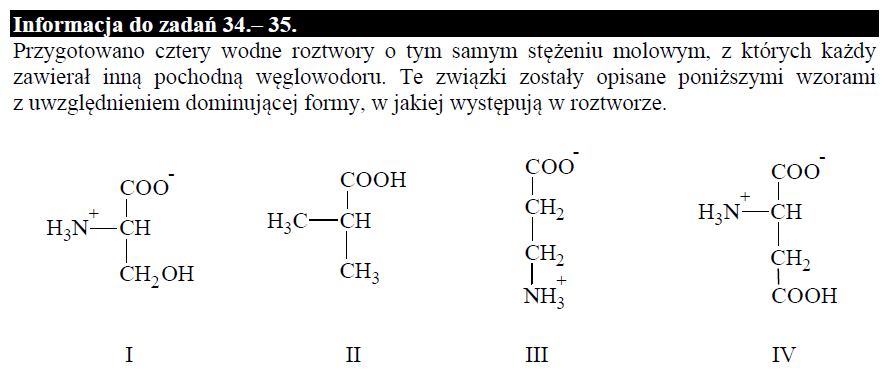

Wg schematu oceniania: 1 - P, 2 - F, 3 - F.
Zwróćmy uwagę na odpowiedź do zadania 1: P.
Dość powszechnie spotyka się przekonanie, że w roztworze o pH<pI dominuje forma kationowa aminokwasu, a w roztworze o pH>pI dominuje frma anionowa. Jest to przekonanie błędne. Oznaczało by to, że istnieje jakaś magiczna wartość pH, w której w miarę podnoszenia pH roztworu w cudowny sposób, bez zachowania ciągłości równowagi w roztworze, zmienia się stężenie poszczególnych form aminokwasów w sposób skokowy. No bo np. dla glicyny (pI=6,11) w roztworze o stężeniu 0,1 mol/dm3 - mamy praktycznie 0,1 mol/dm3 formy obojnaczej. A jak pH pH spadnie do wartosci 6,10, to więcej zrobi się formy kationowej, niż obojnaczej? Przecież to mikroskopijny dodatek kwasu! Jonów obojnaczych jest tam miliardy razy więcej, niż dodatkowych kationów oksoniowych. Jeśli w litrze roztworu mamy 0,1 mola jonów obojnaczych, to żeby sprotonować połowę potrzebujemy 0,05 mola kationów oksoniowych... A to oznacza spadek pH znacznie poniżej pI... Przyjrzyjmy się temu tej zależności zawartości form (tzw. specjacji) w roztworze glicyny w zależności od pH roztworu (w 25 °C). Wykresik wziąłem z Wikipedii. Na wykresie akronimem GlyH oznaczono formę obojętną (jon obojnaczy), GlyH2 - formę kationową (protonowaną), Gly - formę anionową (deprotonowaną).
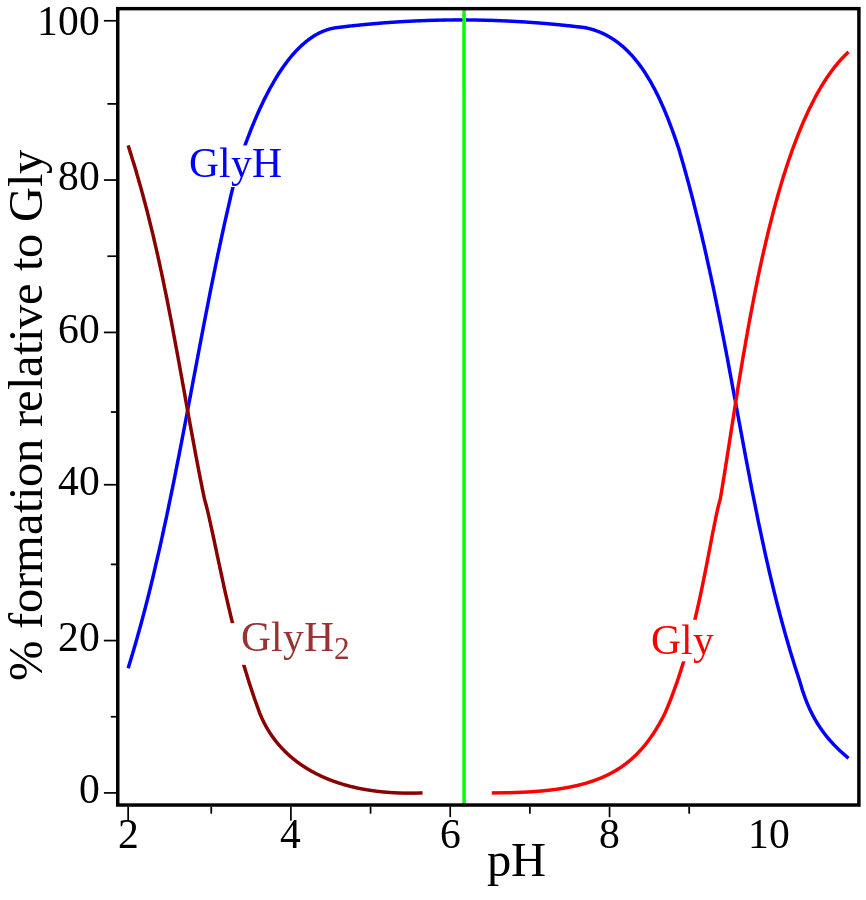
Dla glicyny tą graniczną wartością, poniżej której dominuje forma kationowa jest pH=2,34, a nie 6,11... To błędne myślenia wynika ze skojarzeń z elektroforezą. Poniżej pI zaobserwujemy migrację w kierunku katody - bo w roztworze POJAWIĄ SIĘ formy kationowe, a nie, że są tam praktycznie tylko one. Analogicznie powyżej pI POJAWIAJĄ SIĘ formy anionowe, ale dominować zaczną dopiero powyżej pH=9,78. Migracja w kierunku konkretnej elektrody wynika stąd, że w roztworze obecne są jony o określonym ładunku, a nie że dominują! Choć oczywiście mogą - w odpowiednio niskim lub odpowiednio wysokim pH.
Przeanalizujmy teraz wykres z zadania 31 z maja 2023 i porówjamy go z tym z Wikipedi. Choć zadanie dotyczy alaniny, to różnice są niewielkie (identyczne pI, a graniczne wartości pH to 2,46 i 9,41).
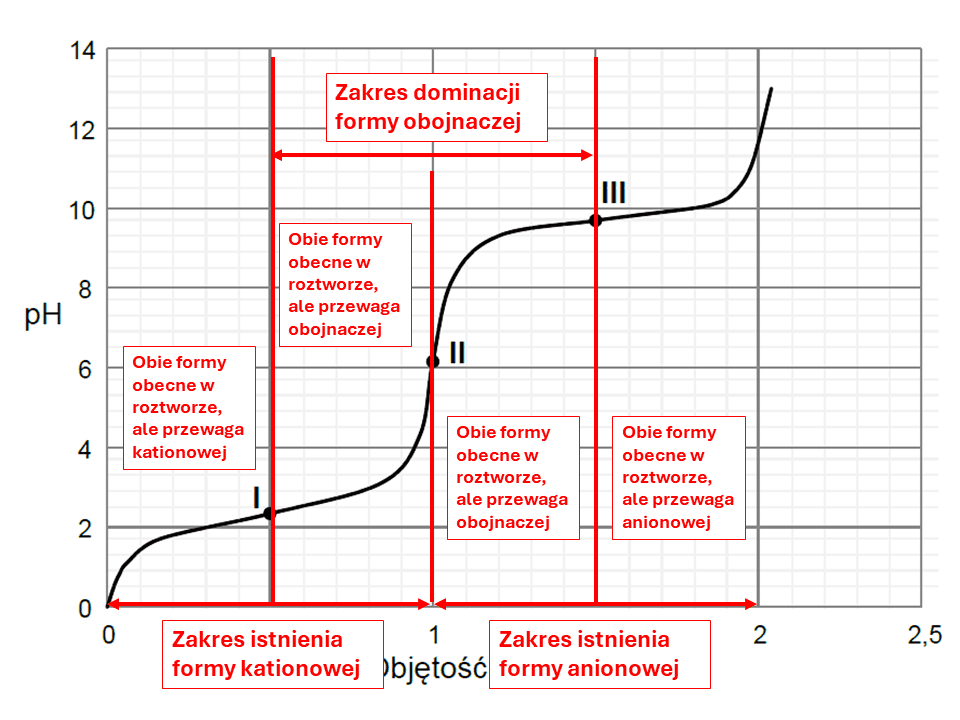
W zadaniu 35. z czerwca 2019 związkiem I jest seryna o pI=5,68. Graniczne wartości to 2,19 i 9,21. W zadaniu mowa o pH<5. Tymczasem aby formą dominującą była forma kationowa, to pH musi być poniżej 2,19. Dalej zwróćmy uwagę, że zadanie z maja 2023 zawiera poprawną informację o tym, że istnieje pewien zakres pH, w którym jon obojnaczy dominuje, co trochę kłóci sie z zadaniem z czerwca 2019, sugerującym, że istnieje tylko taki punkt pH. To jakby wygląda taki wykres w zależności od pH, w którym poniże i powyżej pI od razu formą dominującą byłyby jony o określonym ładunku, a w pI akurat obojnaczy? Cokolwiek ciekawie, ale narysuję go innym razem :)
Pamiętajmy, że matura się zmienia - błędy są stopniowo eliminowane. To, że "kiejsi tak było na maturze/we kluczu" nie znaczy, że następnym razem sytuacja się powtórzy i taka odpowiedź będzie zaliczana, "bo na maturze piszemy że...".