Jeśli wolisz oglądać niz czytać, to zapraszam Cię też do obejrzenia mojej lekcji online o kinetyce chemicznej ;-)
A jeśli lubisz czytać, to życzę miłej lektury ;-)
Prezentowany tekst jest fragmentem drugiej części podręcznika "Podstawy obliczeń chemicznych" i częściowo różni się od wersji zamieszczonej w podręczniku.
Na pytanie ile będzie wynosić stężenie substratu po minucie, jeśli szybkość reakcji wynosi 0,25 mol·dm-3·min-1, a stężenie początkowe wynosi 1 mol/dm3 wiele osób odpowie, że 0,75 mol/dm3. Ale czy na pewno? Z równania kinetycznego wynika, że szybkość reakcji jest funkcją stężenia. Rozpatrzmy przykładową sytuację:
A→B
Równanie kinetyczne przyjmuje postać v=k⋅CA. Przyjmijmy więc początkowe stężenie substratu A za równe 1 mol/dm3, a stałą szybkości równą 0,5 min-1. Oznacza to, że początkowa szybkość reakcji wynosi 0,5 mol·dm-3·s-1, a w chwili, gdy stężenie spadnie do 0,5 mol/dm3 będzie wynosić 0,25 mol·dm-3·s-1.
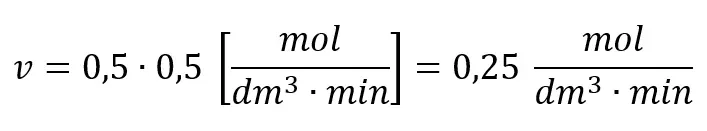
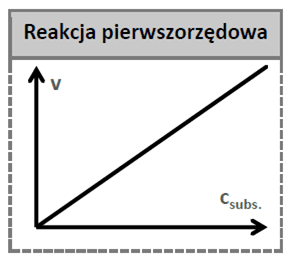
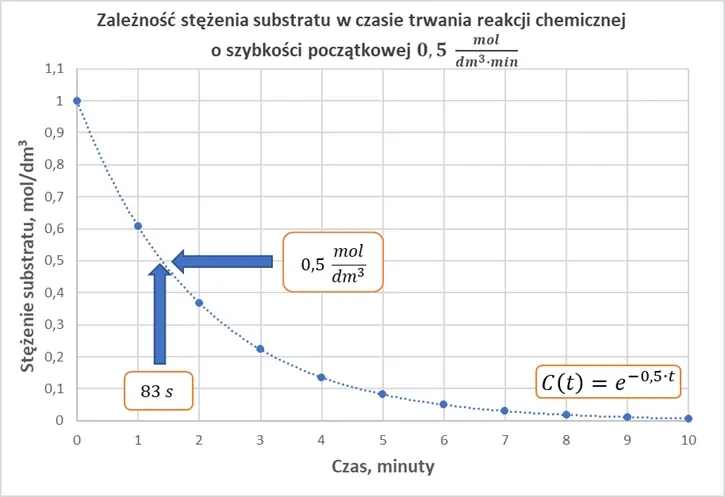
Czy to oznacza, że 1 minucie stężenie A będzie wynosić 0,5 moldm3, a po 2 minutach 0,25 mol/dm3? Spójrzmy na wykres, który przedstawia zależność stężenia substratu A w czasie trwania reakcji.
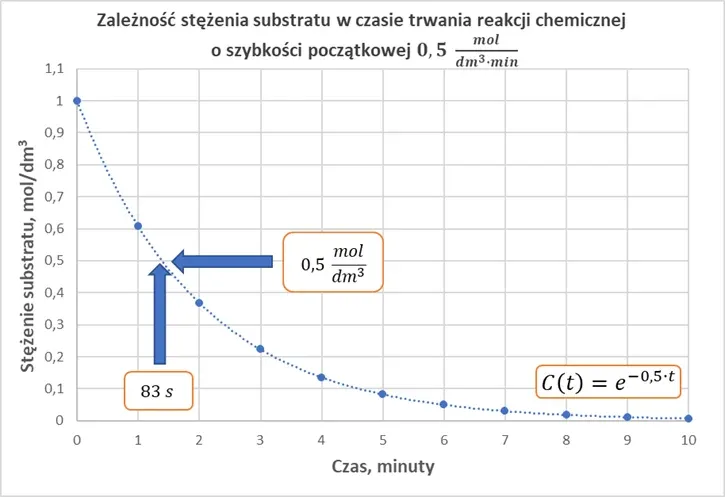
Przyjrzyjmy się jak zmieniało się stężenia w czasie.
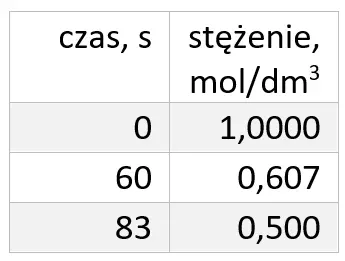
Dostrzegamy znaczną rozbieżność pomiędzy tym, co mówi szybkość reakcji, a tym co obserwujemy: stężenie spadło do 0,5 nie po 1 minucie, a po blisko 1,5 minuty. Do absurdalnej sytuacji dojdzie, gdy przeliczymy jednostkę stałej szybkości na inną:
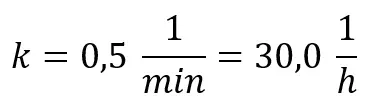
Przy takim rozumowaniu oznaczało by to, że w pierwszej godzinie stężenie musiałoby spaść o 30 mol/dm3, co w naszym przypadku oznacza, że po 2 minutach stężenie substratu osiągnie zero, czyli reakcja się zakończy. Tymczasem jak widzimy i na wykresie, i licząc "ręcznie" minuta po minucie – reakcji daleko będzie do końca w czasie 2 minut od rozpoczęcia. A jeśli policzymy szybkość średnią w czasie pierwszej minuty, to otrzymamy 0,393 mol·dm-3·s-1, co także nie pokrywa się z początkową wartością. Z jąk szybkościa w takim razie zachodziła reakcja chemiczna?
Skąd taka niespójność wyników? Dlaczego szybkość równa 0,5 mol∙dm-3∙s-1 nie oznacza, że w czasie jednej minuty stężenie spadnie o 0,5 mol/dm3?
Zanim na to odpowiem, rozpatrzmy przykładowe dwa zadania:
W naczyniu o stałej objętości i w stałej temperaturze zachodzi reakcja chemiczna dana równaniem:
A→2B
Równanie kinetyczne przyjmuje postać: v=k
Oblicz, jakie będzie stężenie substratu A po 3 sekundach od rozpoczęcia reakcji, jeśli k=0,1 mol·dm-3·s-1, a stężenie początkowe substratu wynosi 1 mol/dm3.
W tym przypadku mamy do czynienia z reakcją zerowego rzędu, czyli reakcją, której szybkość nie zależy od stężenia. Szybkość tej reakcji nie zmienia się w czasie, pomimo tego, że stężenie substratu jest coraz niższe.
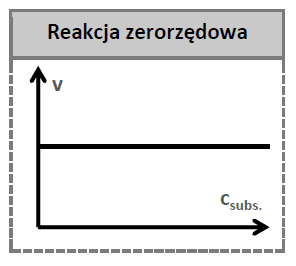
Taką reakcję możemy porównać do ruchu samochodu, które porusza się ze stałą prędkością, np. 20 m/s. Taki samochód w każdej sekundzie pokonuje 20 m.

Obliczenie, jak zmienia się stężenie w czasie zachodzenia reakcji jest więc w tym przypadku proste:
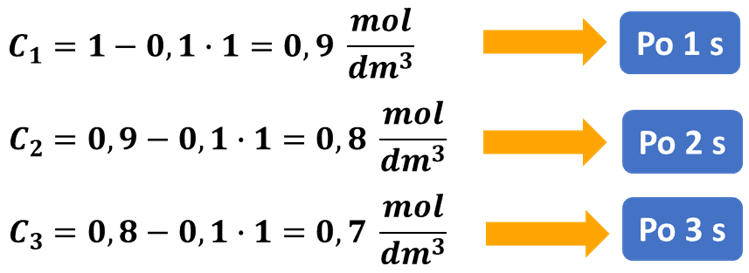
I mamy gotową odpowiedź. A teraz przejdźmy do innego zadania:
W naczyniu o stałej objętości i w stałej temperaturze zachodzi reakcja chemiczna dana równaniem:
Równanie kinetyczne przyjmuje postać: v=k·CA
Oblicz, jakie będzie stężenie substratu A po 3 sekundach od rozpoczęcia reakcji, jeśli k=0,5 s-1, a stężenie początkowe substratu wynosi 1 mol/dm3.
Wiele osób zacznie rozwiązywać to zadanie, tak samo jak w poprzednim przypadku:
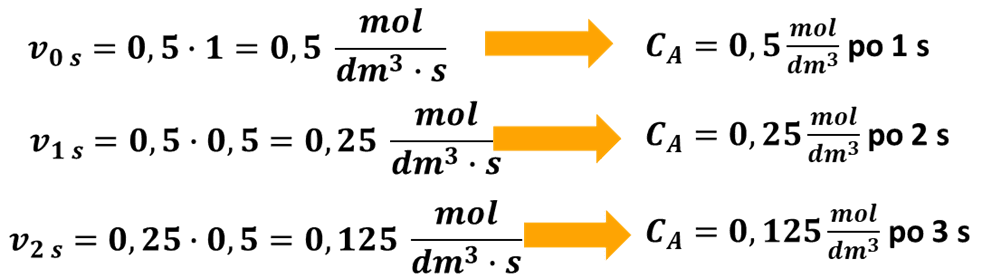
Na pozór to samo, ale nie to samo. Tutaj reakcja jest pierwszorzędowa i jej szybkość zależy od stężenia substratu.
Niestety, ale takie rozumowanie, na którym oparliśmy rozwiązanie jest całkowicie błędne. A zatem:
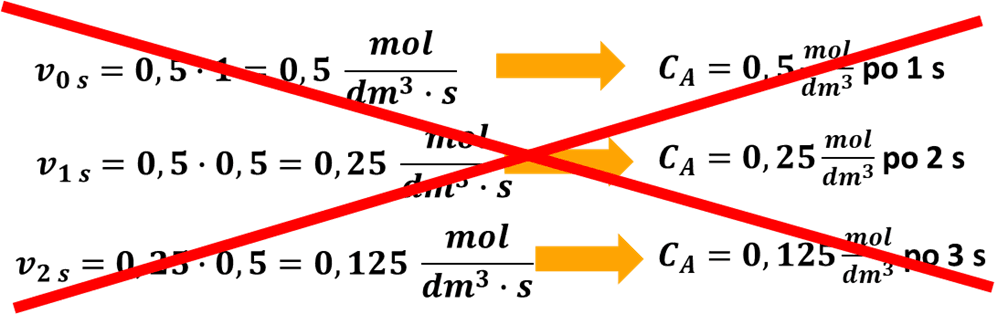
Czego nie wzięliśmy pod uwagę? Tego, że szybkość tej reakcji zmienia się w każdej chwili. Tego, że równanie kinetyczne podaje nam szybkość chwilową, czyli szybkość w momencie, gdy stężenie ma konkretną wartość. Taką reakcję można porównać do ruchu hamującego samochodu. Nasz samochód może jechać z prędkością 20 m/s, ale przecież równocześnie wcisnęliśmy hamulec… Po 1/10 sekundy prędkość samochódu będzie już niższa od 20 m/s, a więc i przejechany w czasie 1 s odcinek będzie krótszy….
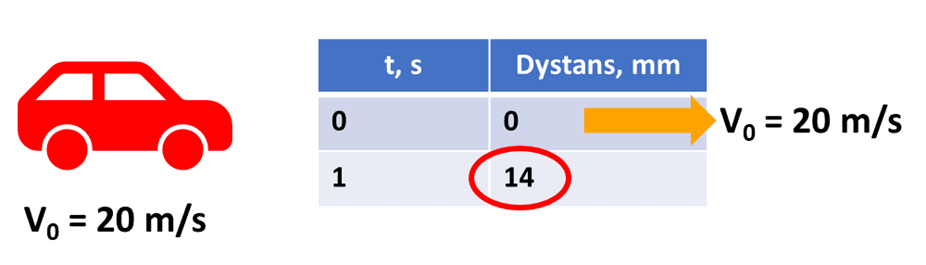
I tu zwróćmy uwagę, że chociaż początkowa szybkość samochodu była identyczna, to jednak przejechany odcinek był krótszy...
A teraz wracamy do szkoły. Rozpowszechnione jest przekonanie, nawet wśród osób zajmujących się edukacją, że szybkość obliczona z równania kinetycznego reakcji informuje nas tym, o ile spadnie stężenie w jednostce czasu. Jak zaraz sami się przekonaliśmy, jest to błędny wniosek, a na nim oparliśmy obliczenia. Zauważmy, że szybkość była równa 0,5 mol·dm-3·min-1 tylko w chwili, gdy stężenie A wynosiło 1 mol/dm3. A przecież po jednej sekundzie od rozpoczęcia reakcji stężenie było niższe od początkowego, to i szybkość była odpowiednio niższa. Szybkość malała w każdej chwili, dlatego też reakcja z każdą sekundą potrzebuje coraz więcej czasu, by osiągnąć stężenie 0,5 mol/dm3. Obliczanie stężenia substratu po każdej jednostce czasu na podstawie szybkości reakcji – jest często spotykanym błędem. Wynika to z faktu, że równanie kinetyczne przedstawia zależność szybkości od stężenia: mówi nam o szybkości chwilowej – o szybkości reakcji w chwili, z której stężenie osiąga jakąś wartość. Ale nie mówi, ile czasu potrzebuje reakcja, by osiągnąć założone stężenie, bo równanie to nie jest zależnością stężenia od czasu. Aby obliczyć drogę samochodu jadącego z tą samą prędkością, mnożymy jego prędkość razy czas:
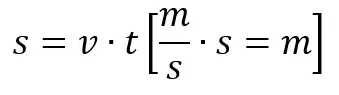
Ale zauważmy, że zarówno w wyrażeniu na prędkość, jak i na drogę pojawia się czas. I wydaje się to proste: jeśli prędkość samochodu wynosi 10 m/s, to po 5 s samochód pokona 50 m. Sytuacja komplikuje się, gdy prędkość samochodu się zmienia, np. samochód hamuje. Tak samo jest w przypadku rozpatrywanej reakcji chemicznej – jej szybkość maleje w czasie, czyli ze spadkiem stężenia substratów. Czy rozpatrujemy drogę samochodu, czy reakcję chemiczną, to musimy skorzystać z równań, w których pojawia się czas. Czas nie jest ukryty w stałej szybkości – takie myślenie także jest błędne. Równanie kinetyczne jest równaniem różniczkowym – szybkość reakcji jest pochodną stężenia w funkcji czasu (stąd v=-dC/dt). Aby otrzymać zależność stężenia od czasu trzeba wykonać czynność przeciwną, czyli całkowanie po dt. Otrzymuje się wtedy tzw. równanie kinetyczne w postaci całkowej, które przedstawia zależność stężenia od czasu trwania reakcji, czyli C(t). W naszym przykładowym przypadku reakcji pierwszorzędowej równanie to ma postać:
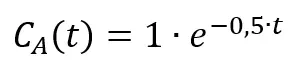
Gdzie 1 oznacza stężenie początkowe, a 0,5 oznacza k. Jest to równanie krzywej, którą widzimy na wykresie.
Ogólnie w przypadku reakcji pierwszorzędowej:
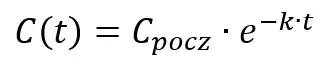
Gdzie Cpocz oznacza początkowe stężenie rozpatrywanego substratu. Równanie w tej postaci często jest mało praktyczne w użyciu, ale staje się przyjaźniejsze po zlogarytmowaniu. W praktyce aby obliczyć zmianę stężenia w czasie często używa się logarytmicznej formy całkowego równania kinetycznego:
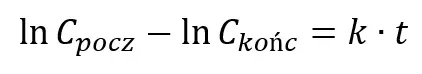
Lub:
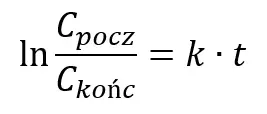
Co w prostych przekształceniach pozwala obliczyć czas potrzebny do osiągnięcia rozpatrywanego stężenia końcowego:
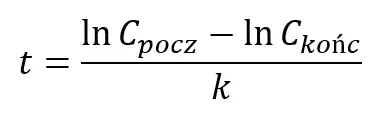
Lub stężenie po jakimś zadanym czasie:
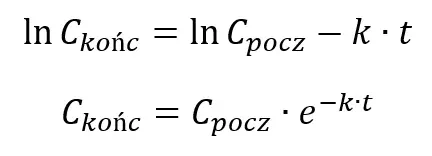
Rozpatrzmy teraz przykład.
Przykład 1. Dla reakcji podanej równaniem stechiometrycznym:
A→B
Równanie kinetyczne przyjmuje postać v=kCA, przyjmijmy więc początkowe stężenie substratu A za równe 1 mol/dm3, a stałą szybkości równą 0,5 min-1.Oblicz czas trwania reakcji, w którym stężenie substratu A spadnie do 0,5 mol/dm3.
Dane: Cpocz=1 mol/dm3, Ckońc=0,5 mol/dm3, k=0,5 min-1
Szukane: t=?
I sposób. Wiemy, że reakcja jest pierwszorzędowa, zatem:
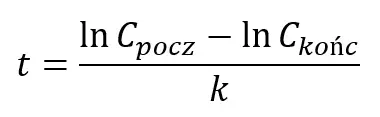
Podstawmy dane z polecenia:
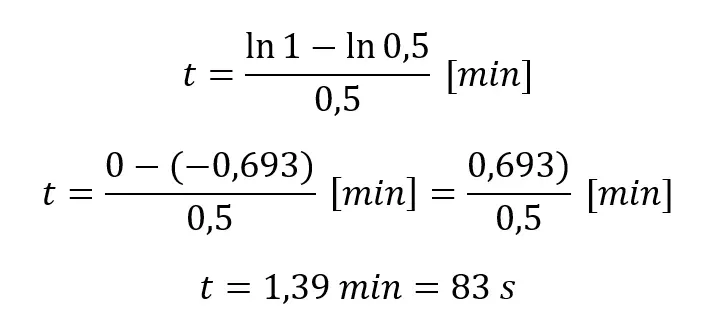
II sposób: Wykorzystamy równanie funkcji wykładniczej:
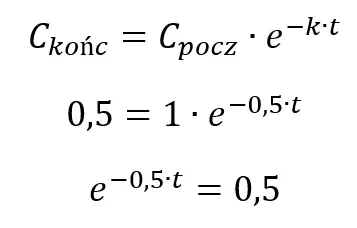
Logarytmujemy:
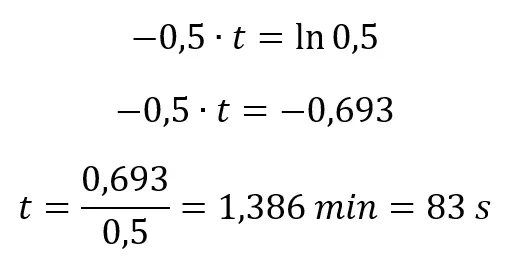
Sprawdzenie:
Sprawdźmy, czy podstawiając otrzymaną wartość czasu do równania otrzymamy stężenie 0,5 mol/dm3:
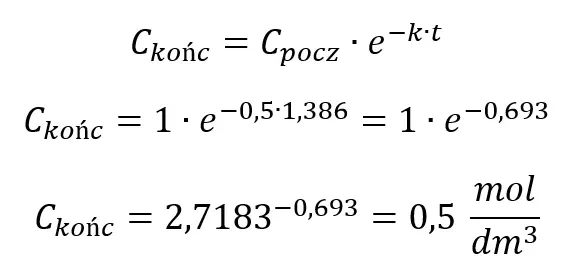
Obliczenia są więc prawidłowe.
Odp: Stężenie osiągnie wartość 0,5 mol/dm3 po 1 minucie i 23 s.
W przypadku reakcji zerowego rzędu szybkość nie zależy od stężenia, a więc jest stała w czasie trwania reakcji, pomimo że zmienia się stężenie.
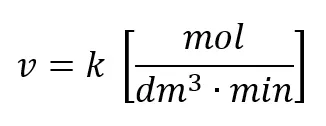
Jedynie w tym przypadku możemy na podstawie szybkości reakcji obliczyć stężenie. Szybkość równa 0,1 mol·dm-3·min-1 oznacza, że w każdej minucie stężenie substratu spada o 0,1 mol·dm-3, np. w czasie 3 minut spadnie z 1 do 0,7 mol/dm3:
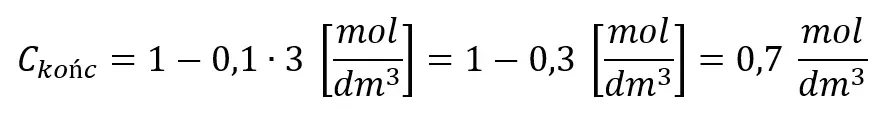
Ogólnie możemy zapisać:
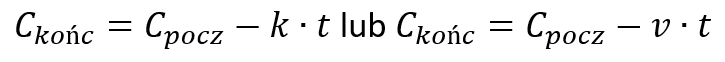
Stężenie końcowe możemy porównać do końcowej prędkości samochodu hamującego ze stałym opóźnieniem (a), które pełni analogiczną rolę jak stała szybkości reakcji:
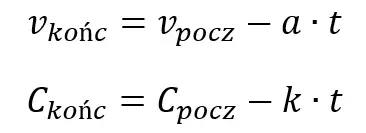
Zmianę stężenia ∆C w jakimś przedziale czasu ∆t możemy porównać do drogi ∆s pokonywanej przez samochód w przedziale czasu.
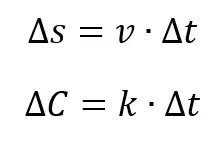
W przypadkach innej rzędowości reakcji – szybkość możemy odnieść do hamującego samochodu, a w pewnych szczególnych – do przyspieszającego samochodu. Ten ostatni przypadek zostanie wyjaśniony w kolejnych rozdziałach. Podsumujmy: aby obliczyć stężenie substratu lub produktu potrzebujemy znać scałkowane równanie kinetyczne, którego postać zależy od rzędu reakcji. Przyjrzyjmy się tabeli:

Przykład 2. Dla reakcji podanej równaniem stechiometrycznym:
A→B
przyjmijmy początkowe stężenie substratu A za równe 1 mol/dm3. Oblicz początkową szybkość reakcji oraz stężenie substratu A po 1 minucie od zainicjowania reakcji, przyjmując, że reakcja jest drugiego rzędu i k=0,5 dm3·mol-1·min-1.
Dane: Cpocz=1 mol/dm3, t=1min, k=0,5 dm3·mol-1·min-1
Szukane: vpocz=?, Ckońc=?
Rozwiązanie. Ponieważ reakcja jest drugiego rzędu, to równanie kinetyczne przyjmuje postać:
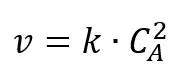
Początkowa szybkość reakcji wynosi zatem:
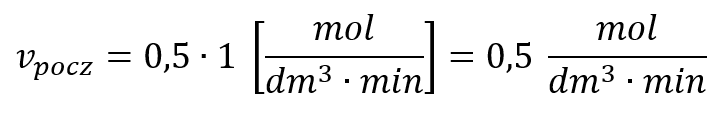
Teraz obliczamy stężenie substratu po minucie korzystając ze scałkowanego równania kinetycznego: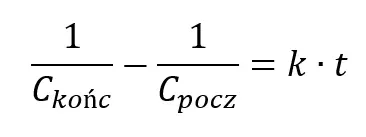
Przekształcamy: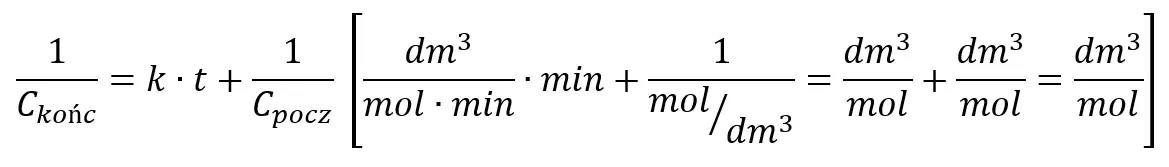
Podstawiamy dane:
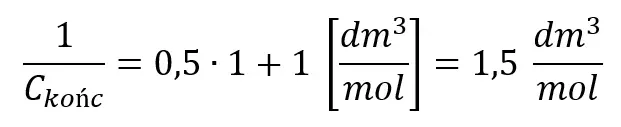
I odwracamy:
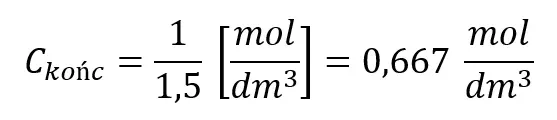
Sprawdzenie:
Obliczmy czas potrzebny by stężenie substratu wyniosło 0,667 mol/dm3. Przekształcamy więc równanie całkowe, dzieląc je przez k
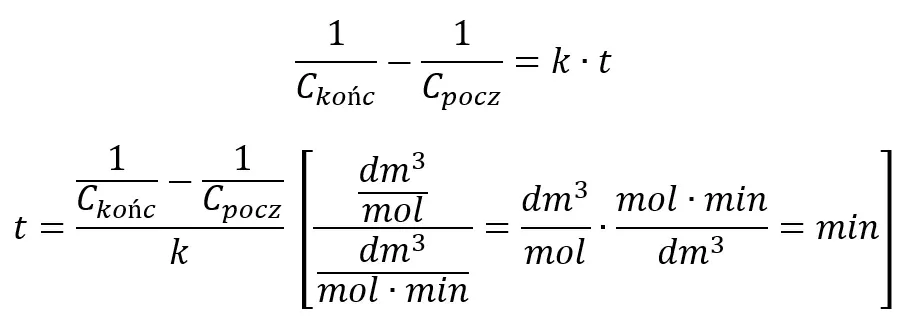
Podstawiamy:
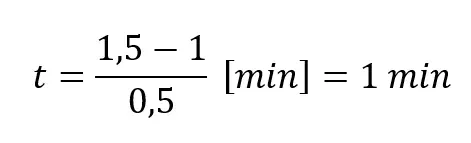
Wynk jest więc prawidłowy.
Odp: stężenie substratu A po 1 minucie wynosi 0,667 mol/dm3.
Zauważmy, że choć początkowe stężenia i szybkość reakcji były identyczne, to jednak wynik jest inny niż w przypadku reakcji pierwszorzędowej i inny będzie w przypadku reakcji zerorzędowej. Przyjrzyjmy się tabeli: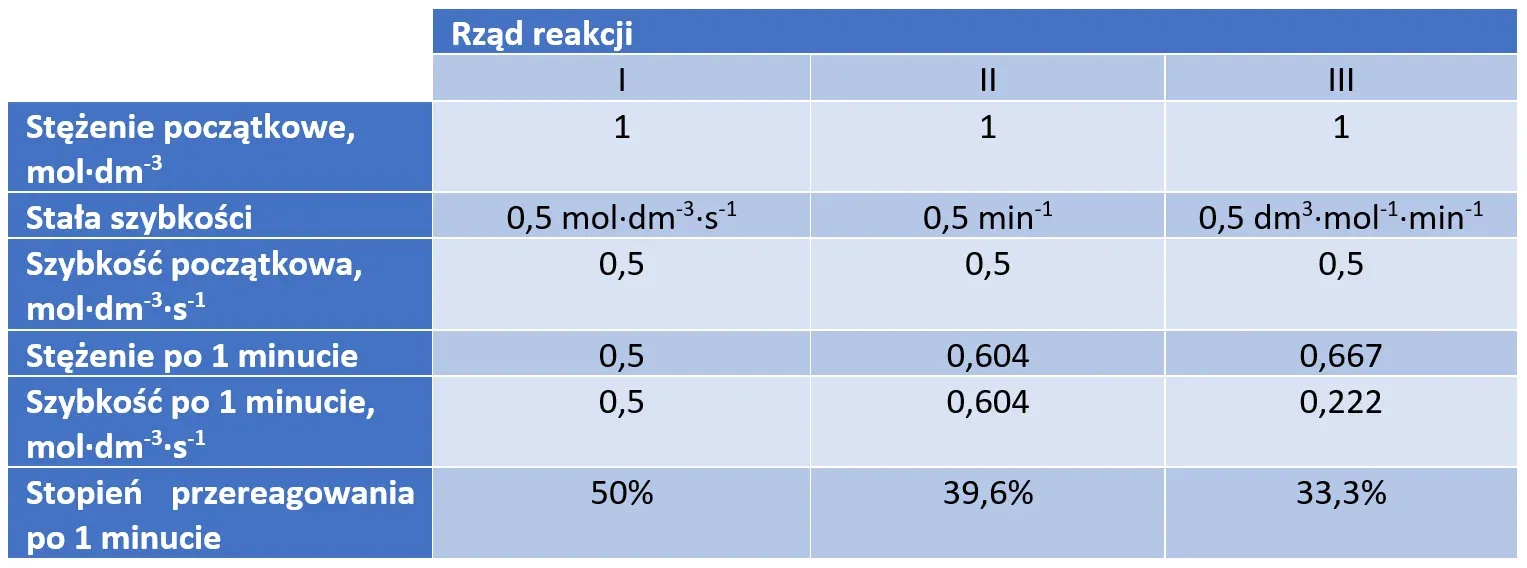
Zauważmy, że największy stopień przereagowania (a więc i wydajność) otrzymamy w tym samym czasie, gdy reakcja jest zerowego rzędu, a najmniejszy – gdy jest rzędu drugiego. Jest to konsekwencją zależności szybkości reakcji od stężenia. Szybkość reakcji zerorzędowej nie zmieniła się po minucie, pierwszorzędowej spadła o 39,3%, a drugorzędowej: spadła aż o 55,6%.
Jeśli uważasz, że artykuł jest przydatny i spełnia swoje zadanie, to z szczegółowe informacje (m.i. spis treści) o podręczniku "Podstawy obliczeń chemicznych" jak i możliwość jego nabycia zawarte są po kliknięciu w łącze.
Ponadto, dla maturzystów, którzy stanowią liczbą grupę czytelników przydatna będzie poniższa infografika :)