Przeanalizujmy to zadanie:
Podobny przypadek zdarza się w zbiorach zadań. Ołów rzeczywiście tworzy związki, w których przypisuje się mu stopnie utlenienia II i IV. Czy jednak możliwe jest użycie wodnego roztworu soli ołowiu(IV), a więc roztworu zawierającego kationy Pb4+? Z pierwszego zdania wynika, że tak. Ale proste kationy o takim ładunku to rzadkość. O ile znane są wszystkie halogenki ołowiu(II): PbF2, PbCl2, PbBr2, i klasyczny złotożółty PbI2, o tyle w przypadku ołowiu(IV) znane są tylko dwa: PbF4 i PbCl4. Tetrafluorek o dużym udziale jonowego charakteru jest jedynym trwałym w temperaturze pokojowej halogenkiem ołowiu. Natomiast kowalencyjny PbCl4 jest cieczą w temperaturze pokojowej (temp. topnienia -15 °C). Rozkłada się nawet w temp. pokojowej na chlor i PbCl2:
PbCl4 → PbCl2 + Cl2
A ogrzany - wybucha.
Halogenki Pb(IV) mają jedną wspólną cechę: nie istnieją w wodnych roztworach. Wprowadzone do wody nieodwracalnie hydrolizują z utworzeniem PbO2:
PbF4 + 2H2O → PbO2 + 4HF
PbCl4 + 2H2O → PbO2 + 4HCl
ponadto w tym drugim przypadku powoli uwalnia się chlor, wskutek następczej reakcji:
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
Wykonanie więc doświadczenia w wersji przedstawionej w zadaniu jest w praktyce niemożliwe, bo nie można otrzymać Pb4+(aq).
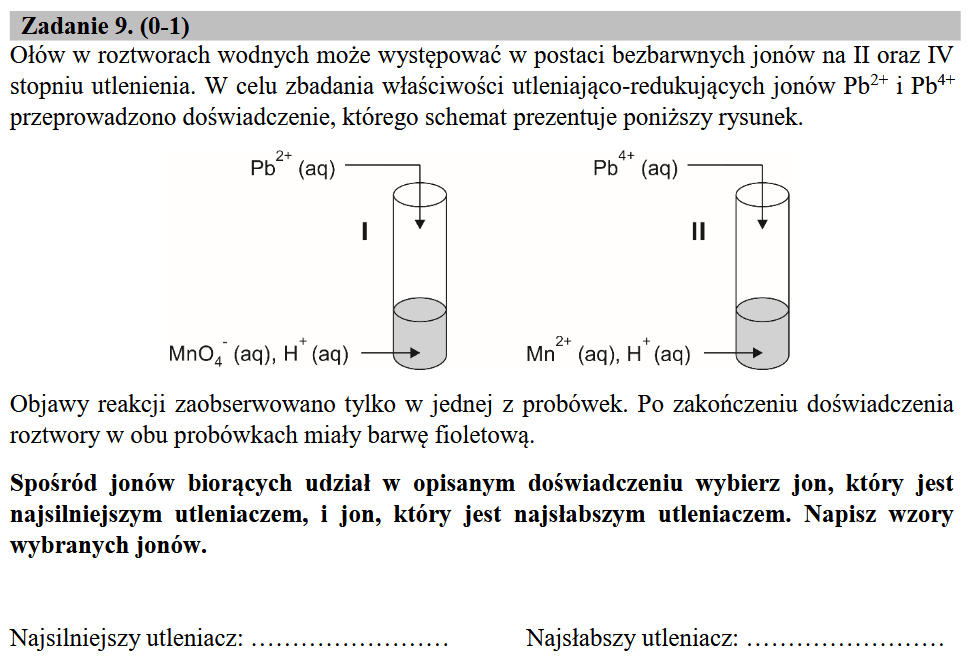
Ale spójrzmy na tablice standardowych potencjałów redukcji zaczerpniętych z "Poradnika fizykochemicznego" (WNT, 1974):
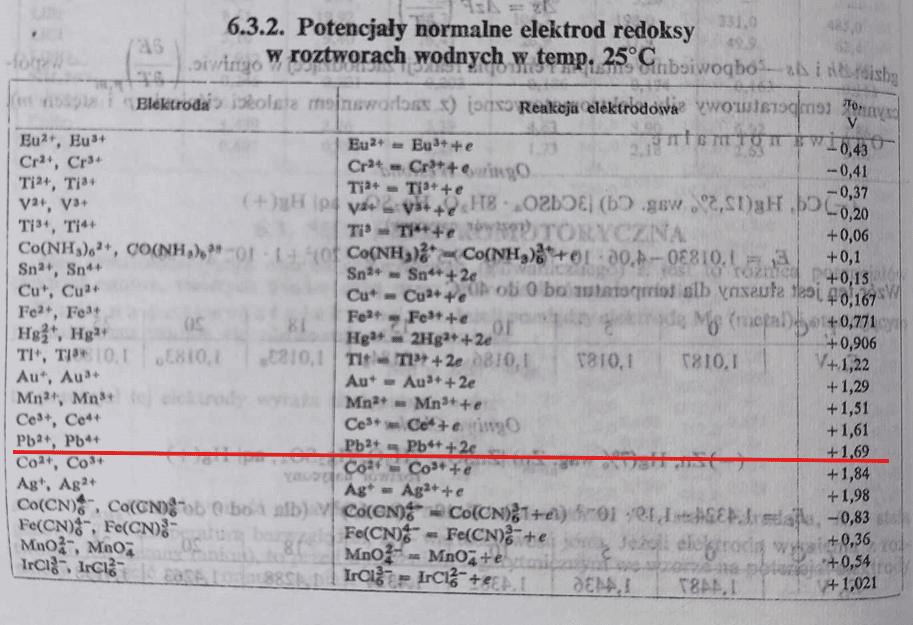
A teraz popatrzmy na nowe karty wzorów CKE. Brak w nich standardowego potencjału redukcji półogniwa Pb4+ + 2e → Pb2+.
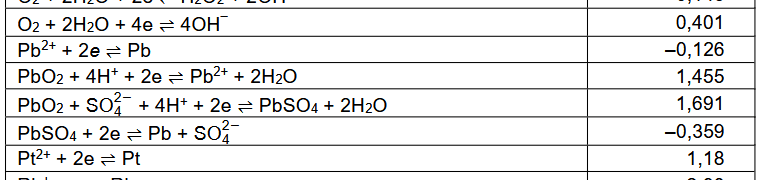
Nie ma go także w "CRC Handbook of Chemistry and Physics, 97th Edithion" (CRC Press, 2017) - źródle, z którego korzystano przy tworzeniu nowych tablic CKE. Za to w obu źródłach jedna wartość wygląda dziwnie znajomo:
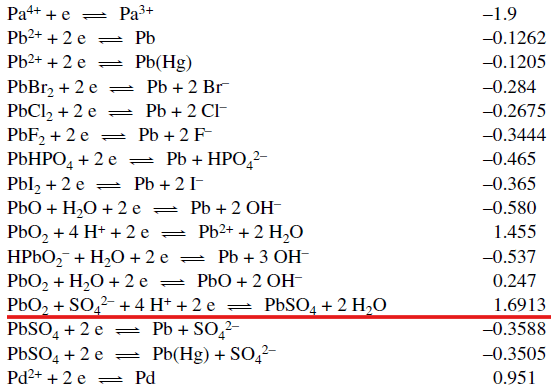
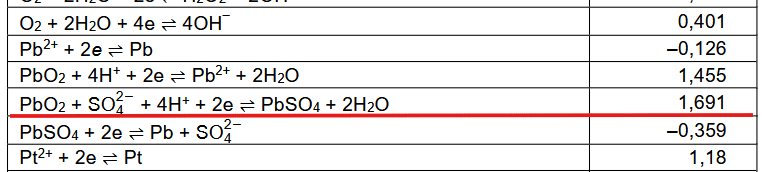
Czy domyślamy się, o co tu chodzi? Po prostu w starych źródłach to samo półogniwo zapisywano jako Pb2+ → Pb4+ + 2e. Dawniej stopnie utlenienia zapisywano także w taki sposób, że wyglądało to na ładunki jonów. I to jest źródłem błędnych wniosków, że można sobie takiego redoksa z roztworem Pb4+ zrobić. A tymczasem to jest redukcja PbO2...
Doświadczenie, które jest przedstawione w zadaniu prawdopodobnie miało być reakcją Cruma - reakcją, w której używa się "Pb4+" - czytaj: PbO2... I to PbO2(s) miał się tam znaleźć, a nie Pb4+(aq). Najsilniejszym utleniaczem nie są jony Pb4+, tylko PbO2.