Zadania buble
Prezentowane w tej sekcji zadania są zadaniami opartymi na błędnych założeniach i wprowadzają w błąd lub ich rozwiązanie jest błędne. Takie zadania nie powinny trafiać do uczniów/studentów, czy nauczycieli chemii, bo nie służą budowaniu świadomości chemicznej, tylko utwierdzają w błędnym myśleniu.
Przeanalizujmy to zadanie:

Początkowo roztwór zawiera 0,02 mol Fe2+ i 0,12 mol Fe3+, a dodano 0,25 mola Zn. Z treści wynika, że do roztworu przeszło 0,005 mol kationów Zn2+, zatem w stanie równowagi stężenie Zn2+ wynosi 0,025 mol/dm3, Fe2+ - 0,15 mol/dm3 a Fe3+ - 0,55 mol/dm3. Czego tu nie wzięto pod uwagę? Ze mamy jeszcze 0,245 mol Zn... A przecież od uczniów wymaga się, by umiał się posługiwać szeregiem napięciowym metali. Kationy Fe2+ ulegną redukcji przez cynk:
Zn + Fe2+ → Zn2+ + Fe
Mamy więc układ reakcji następczych. Pamiętaj, że obecnie matura wymaga nie tylko obliczeń dla samego liczenia, ale takze wykorzystywania wiedzy chemicznej i kojarzenia faktów. Musisz przecież wiedzieć, co sie stanie, jak do roztworu z kationami Fe2+ pwrowadzimy cynk. Ponadto, gdyby zbudować takie standardowe ogniwo, w którym zachodziłaby opisana redukcja Fe3+ do Fe2+, to jego potencjał standardowy (SEM) wynosiłby 1,533 V. Zgodnie z zależnością (tego już maturzyści nie muszą umieć obliczyć ;) ):
RTlnKc = nFE
lnKc = nFE/RT
lnKc = 2 · 96500 · 1,533/(8,314 · 298,15) = 119,4
Co nas prowadzi do wyniku:
Kc = 6,9 · 1051
To ogromna liczba. Oznacza to, że reakcja ta jest praktycznie nieodwracalna i wszystkie kationy Fe3+ ulegną zredukowaniu do Fe2+, bo mamy spory nadmiar cynku. Wg stechiometrii na redukcję wszystkich kationów Fe3+ zużyje się 0,06 mola cynku. Po ich wyczerpaniu pozostanie go jeszcze 0,19 mola, a roztwór będzie zawierał 0,14 mol kationów Fe2+. A jak kationy Fe2+ reagują z cynkiem to już wyjaśniliśmy:
Zn + Fe2+ → Zn2+ + Fe
Stała równowagi tej reakcji wynosi 4,5·1011, więc możemy także przyjąć, że jest to reakcja nieodwracalna i zachodzi w 100%. Ponieważ cynk nadal jest w nadmiarze do kationów Fe2+, to całe żelazo zostanie usunięte z roztworu. Układ poreakcyjny zawiera więc: 0,05 mol nieprzereagowanego nadmiaru cynku, 0,14 mol żelaza i 0,20 mol kationów Zn2+ w roztworze, czyli stężenie kationów cynku będzie wynosić. 1 mol/dm3. Otrzymamy po prostu roztwór octanu cynku.
Zadanie takie, w odpowiednio zmodyfikowanej wersji - może pojawić się na maturze.
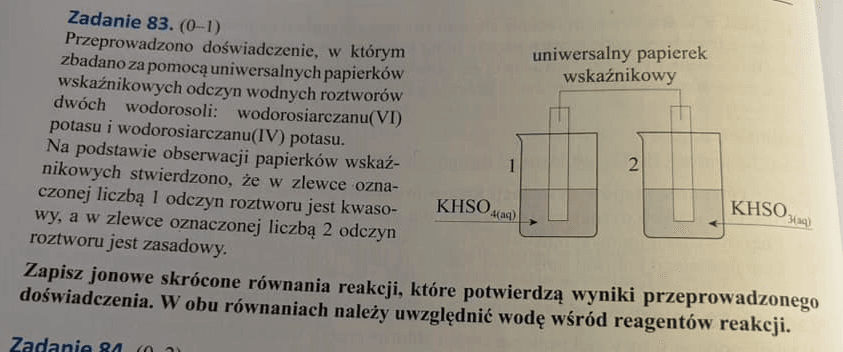
Przyjrzyjmy się temu zadaniu:

A teraz poleceniu i odpowiedzi do niego:
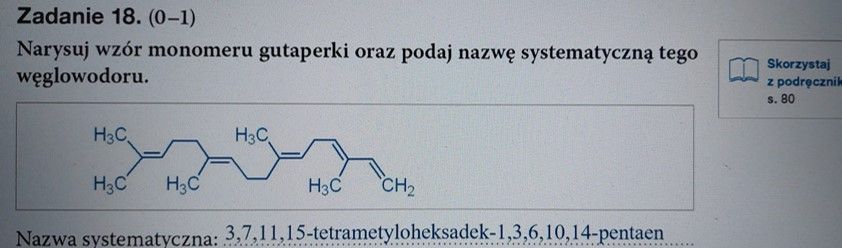
Choć sam wzór polimeru jest poprawny, to te odpowiedzi są, niestety, błędne. Niemal identycznie narysowany wzór gutaperki znajdujemy na Wikipedii.
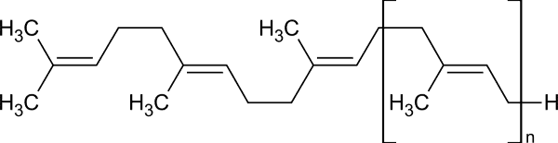
Wzór ten jest POPRAWNY. Prawdopodobnie nim zasugerował się autor/autorka zadania. Problem w tym, że został źle zinterpretowany. Autor potraktował łańcuch poza nawiasem kwadratowym jako podstawnik meru (łańcuch boczny). fragment TEN przedstawia 3W rzeczywistości mery. Cała makrocząsteczka zbudowana jest więc z n+3 merów:
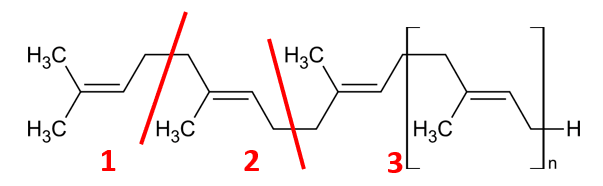
Wzór ten jest więc jest tożsamy z tym narysowanym po prawej stronie: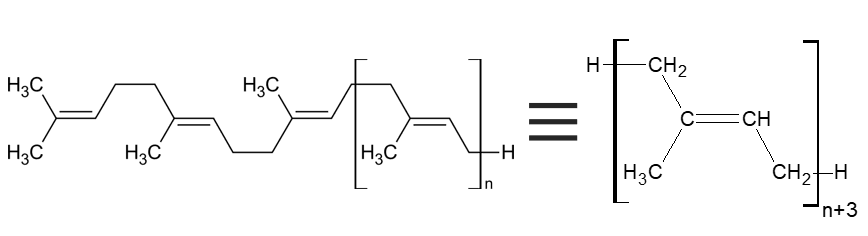
Gutaperka jest trans-1,4-poliizoprenem - geometrycznym izomerem kauczuku naturalnego (cis-1,4-poliizoprenu). Monomerem jest więc w obu przypadkach izopren.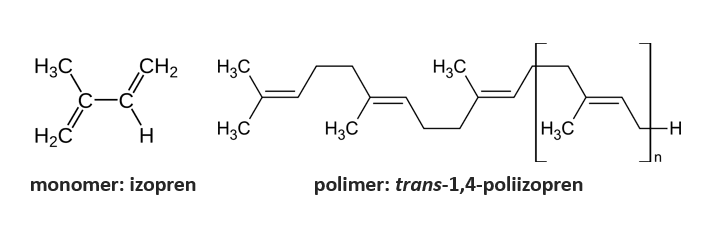
Gdyby fragment makrocząsteczki poza nawiasem kwadratowym miał być łańcuchem bocznym, to wzór polimeru musiałby wyglądać tak. A monomerem byłby 3,7,11,15-tetrametyloheksadek-1,3,6,10,15-pentaen.
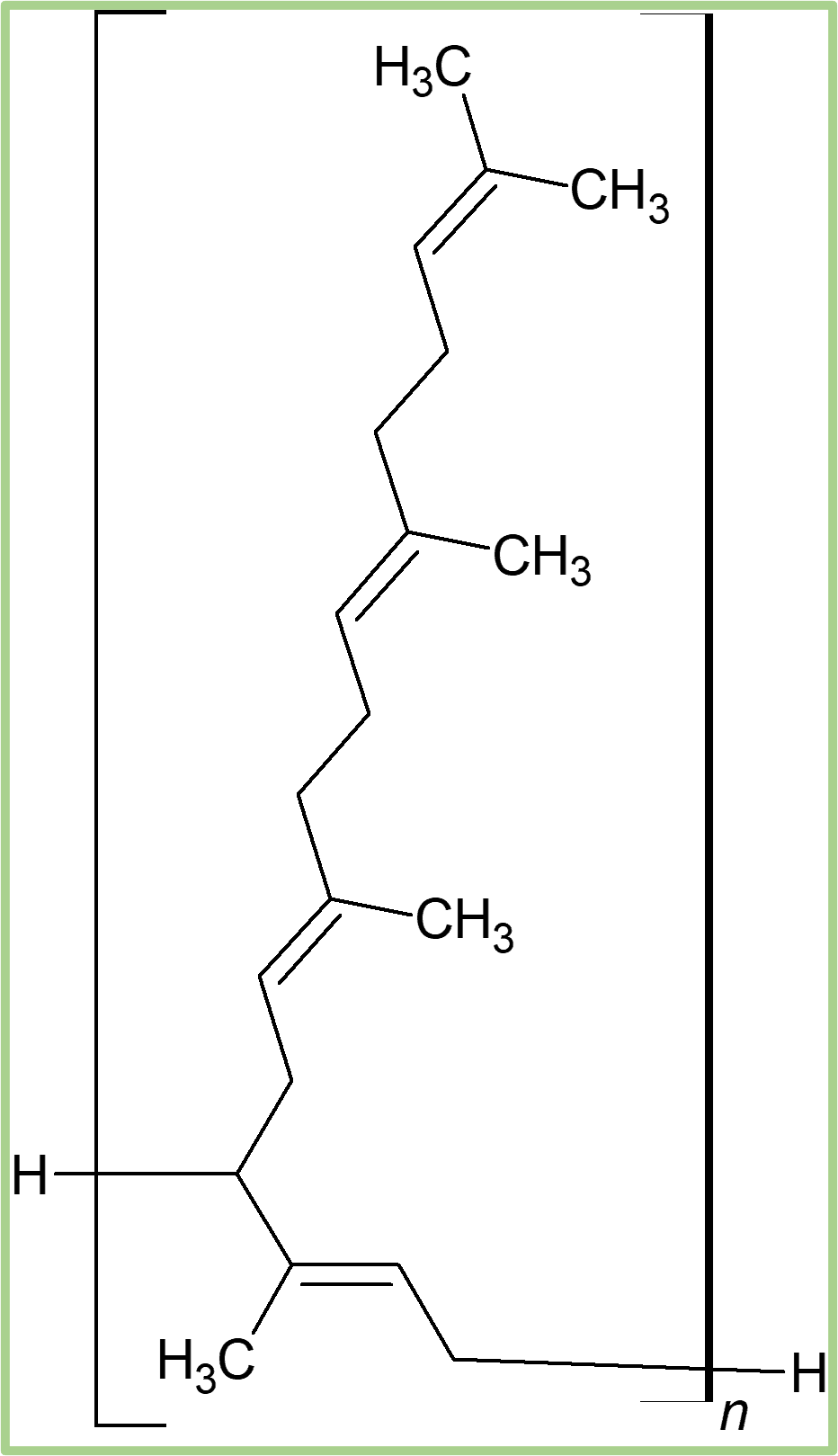
Przy wzorach polimerów trzeba zachować ostroźność, żeby ich źle nie zinterpretować.
Przyjrzyjmy się temu zadaniu pochodzącemu prawdopodobnie z którejś próbnej matury:

Odpowiedź oznacza, że myjemy się roztworem NaOH. Przypominam, że na maturze za zapisanie równania reakcji odwracalnej ze strzałką w jedną stronę nie utracimy punktów. Jest to po prostu błąd dopuszczalny, a nie poprawna odpowiedź (maturzyści często nie mają świadomości tego, że pewne odpowiedzi w schematach oceniania to są tolerowane błędy, a nie rzeczywiście poprawne odpowiedzi). Ale do rzeczy. Za samo zapisanie równania reakcji odwracalnej z jedną strzałką punktów nie utracimy. Ale jeśli przy okazji wyciągniemy błędne wnioski – to już tak. Formalnie strzałkę w prawo stosujemy w przypadku reakcji nieodwracalnych: zachodzących z lewa na prawo w 100% (w praktyce jest prawie równe 100%, np. w reakcji zobojętniania pewna ilość jonów H3O+ i OH- pozostanie po reakcji, ze względu na równowagę dysocjacji wody). Wracamy do zadania. Hydroliza soli, czyli także mydeł, które są solami jest procesem odwracalnym, ponadto zachodzi w bardzo małym stopniu (można sobie liczyć, że w roztworze CH3COONa o stężeniu 0,1 mol/dm3 hydrolizie ulega zaledwie 1 na 13400 anionów octanowych, czyli stopień przemiany jest poniżej 0,01%! I to samo mamy w roztworze mydła. Nieznaczna liczba anionów karboksylowych hydrolizuje, ale blisko 100% z nich pozostaje niezmienionych (kwasy tłuszczowe są praktycznie tej samej mocy co kwas octowy). A dlaczego mydło myje? Właśnie dzięki tym anionom, które mają czynność powierzchniową. Gdyby one zniknęły w procesie hydrolizy, to byśmy myli ręce roztworem NaOH. Takie mycie rąk na długo by nam zapadło w pamięci…A zresztą to po nam mydło, skoro i byśmy się myli roztworem NaOH? To nie lepiej byłoby sprzedawać po prostu NaOH do mycia rąk? Byłoby taniej w produkcji. Ale czy dla rąk lepiej to mam pewne wątpliwości. Kilka lat temu dostałem informacje, że pewien korepetytor tłumaczy, że hydroliza mydeł zachodzi nieodwracalnie ze względu na to, że kwasy tłuszczowe są nierozpuszczalne i ich hydrolizę trzeba zapisywać z jedną strzałką… Pozwolę sobie tego dalej nie komentować. Jedyne co mogę dodać, to tyle, że rzeczywiście bardzo mała rozpuszczalność tych kwasów wodzie zwiększa stopień hydrolizy w stosunku do kwasów o tej samej mocy, ale dobrze rozpuszczalnych, ale stopień hydrolizy nadal jest bardzo mały - na szczęście dla naszej skóry.
Podobną tematykę poruszałem już tutaj: Hydroliza soli – typowe błędy.
Przyjrzyjmy się temu zadaniu:
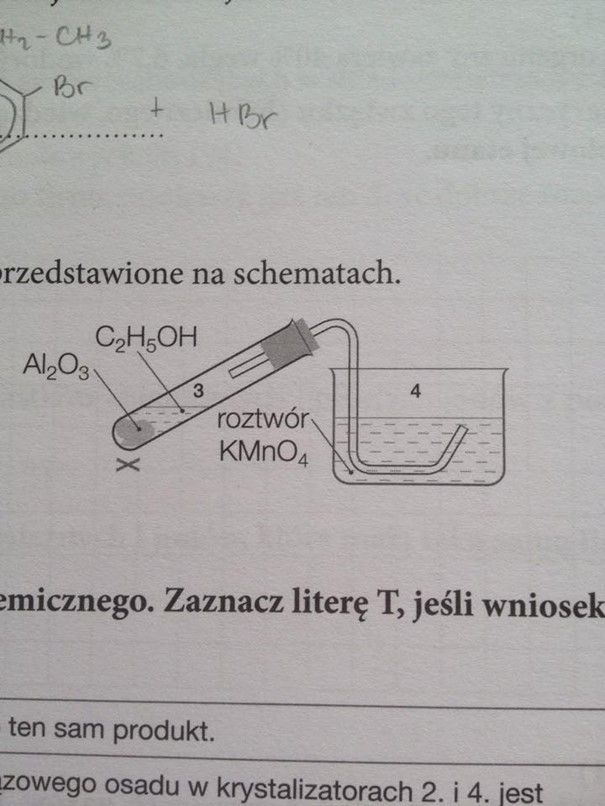
Niestety nie mam lepszej fotki. To doświadczenie jest źle zaplanowane nie ma prawa działać to tak, jak sądził autor. Reakcję odwadniania alkoholi nad Al2O3 przeprowadza się w fazie parowej (gazowej) i w znacznie wyższych temperaturach (200 - 300 °C). Parę etanolu lub innego aolkoholu przepuszcza się przez złoże Al2O3. Etanol wrze w 78 °C pod normalnym ciśnieniem. W zestawie widocznym na obrazku etanol ogrzeje się się do 78 °C i zacznie wrzeć. Para zacznie przechodzić do rurki, która zachowa się jak chłodnica. Etanol skropli się w rurce. Autor nie uwzględnił także, że w tak zmontowanym zestawie roztwór KMnO4 po prostu wleje się do rurki. A etanol reaguje z wodnym roztworem KMnO4, początkowo reakcja zachodziłaby w rurce z roztworem, który się do niej wlał, a nieco później, gdy etanol zacznie się już przedostawać do zlewki (lub krystalizatora) to zacznie się utleniania etanolu w nim. W takim zestawie nie otrzymamy etenu, który miał na myśli autor.
Widziałem kiedyś podobne zadanie w jakimś próbnym arkuszu, w którym ktoś otrzymywał propanal przez ogrzewanie w łaźni wodnej probówki z propan-1-olem z dodatkiem CuO... Niestety, tro trochę inaczej działa i doświadczenie było zaplanowane błędnie.
Przyjrzyjmy się temu zadaniu:

Nie mozna otrzymać takiego roztworu, jak podaje tabelka dla roztworu 1. Wynika to stąd, że w takim roztworze zajdzie reakcja synproporcjonowania:
5Br- + BrO3- + 6H3O+ → 3Br2 + 9H2O
Po zmieszaniu składników w roztworze nie będzie anionów bromkowych, ze względu na nadmiar anionów bromianowych(V) - aniony bromkowe zostaną z niego usunięte. Do faktu, że aniony bromkowe zostaną utlenione nawiązuje zresztą to zadania z matury w 2017 roku:

A co mamy w roztworze 1? Aniony bromkowe, brominowe(V) i kwas...
Przyjrzyjmy się temu zadaniu:
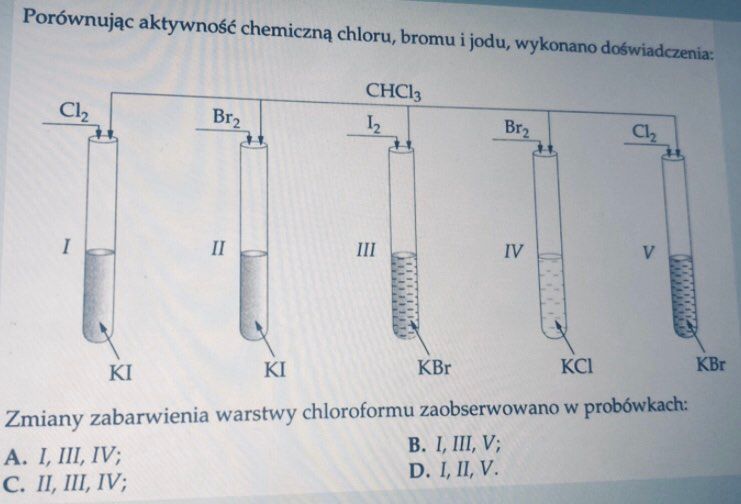
W proponowanym zestawie odpowiedzi nie ma poprawnej odpowiedzi. Wygląda na to, że autor uznał, że jeśli gdzieś nie zachodzi reakcja chemiczna, to chloroform nie zmieni zabarwienia. Przyjrzyjmy się probówce I. Zajdzie w niej reakcja chemiczna:
2I- + Cl2 → I2 + 2Cl-
I to ten jod rozpuści się w chloroformie i nada mu fioletową barwę. Podobnie będzie w probówce II:
2I- + Br2 → I2 + 2Br-
Tutaj także powstający jod zabarwi chloroform na fioletowo. A co w probówce nr III? Tutaj nie zajdzie reakcja chemiczna. Zwróćmy uwagę, że mamy tam Br- i I2 - to samo, co w wyniku reakcji chemicznej powstało w probówce II - a tam doszło do zabarwienia z powodu obecności jodu. Jod jest w probówce III, a więc rozpuści sie w chloroformie i nada fiolletową barwę warstwie organicznej.W probówce IV nie dojdzie do wyparcia chlorowoca, ale brom takze dobrze rozpuszcza się w chloroformie i nadaje mu barwę - brunatną.
Do wyparcia chlorowca dojdzie w probówce V:
2Br- + Cl2 → Br2 + 2Cl-
Tutaj takze brom zabarwi jod na brunatno. A zatem we wszystkich probówkach dojdzie do zmiany barwy chloroformu, chociaż nie w każdej dojdzie do reakcji wyparcia chlorowca. Takie doświadczenia można zobaczyć na filmie:
Przyjrzyjmy się temu zadaniu:

Oryginalna odpowiedziedź mówi, że to 50,36 dm3. Ale to nie jest prawidłowa odpowiedź.
Jak można policzyć, mieszanina zawiera 0,286 mola CO2 i 0,08 mola NaOH w płuczce. Podczas przepuszczania mieszaniny przez płuczkę z NaOH(aq) początkowo powstaje węglan sodu:
2NaOH + CO2 → Na2CO3 + H2O
W tej sytuacji cały NaOH (0,08 mola) przereaguje z 0,04 mola CO2. Po reakcji pozostanie zatem 0,246 mola CO2. Roztwór Na2CO3 także pochłania CO2:
Na2CO3 + H2O + CO2 → 2NaHCO3
Mamy więc układ reakcji następczych. Jak rozumieć podaną wydajność 90%? Do której z tych reakcji się odnosi? Nie ma możliwości, by pierwsza z nich zaszła z wydajnością 90%, i potem CO2 obraził się i przestał reagować. Nie ma możliwości też, by obie zaszły z wydajnością 90% - bo aby zaszła druga musi się zakończyć pierwsza.
Nieco lepiej sytuacja wygląda z NH3 - ten też jest w nadmiarze w stosunku do H2SO4, ale rozwiązanie autora nie uwzględnia, że przecież NH3 dobrze rozpuszcza się w wodzie. Z rozpuszczalnością CO2 jest gorzej, ale... Jeszcze jeszcze ważna rzecz...
Ponieważ gazy są w nadmiarze zarówno w stosunku do NaOH jak i do CO2, to po wyczerpaniu się H2SO4 i NaOH/Na2CO3 w układzie pozostaje 0,189 mola NH3 i 0,206 mola CO2. Gazy te będą ze sobą reagować w obecnosci wody w obu płuczkach:
NH3 + CO2 + H2O → NH4HCO3
Rozwiązanie nie uwzględnia natury zachodzących reakcji chemicznych w takim układzie i jest oparte na błędnych założeniach. Autor założył, że powstanie Na2CO3 w ilości 0,036 mol i (NH4)2SO4 w ilości 0,108 mola. Resztę pominął.
Przyjrzyjmy się temu zadaniu:

A teraz oryginalną odpowiedź do niego:

autor słusznie zauważył, że wapń będzie reagował z wodą z wydzieleniem wodoru. Ale nie uwzględnił, że wodorotlenek wapnia wytrąci znacznie gorzej rozpuszczalny Cu(OH)2:
Ca(OH)2 + CuSO4 → Cu(OH)2 + CaSO4
Sumarycznie równanie reakcji można napisać tak:
Ca + 2H2O + CuSO4 → CaSO4↓ + Cu(OH)2↓ + H2
Ostatecznie jony Cu2+ i jony Ca2+ są usuwane z roztworu w postaci trudno rozpuszczlanych związków: Cu(OH)2 i CaSO4. Roztwór poreakcyjny zawier nieznaczne ilości jonów Ca2+ i SO42-, ze względu na nieznaczną rozpuszczalnosć CaSO4. Z kolei Cu(OH)2 jest praktycznie nierozpuszczalny. Podobną sytuację przedstawiam tutaj:
Z takim zadaniem zmierzyli się uczniowie klas maturalnych podczas tzw. próbnej matury jesienią 2020. roku.
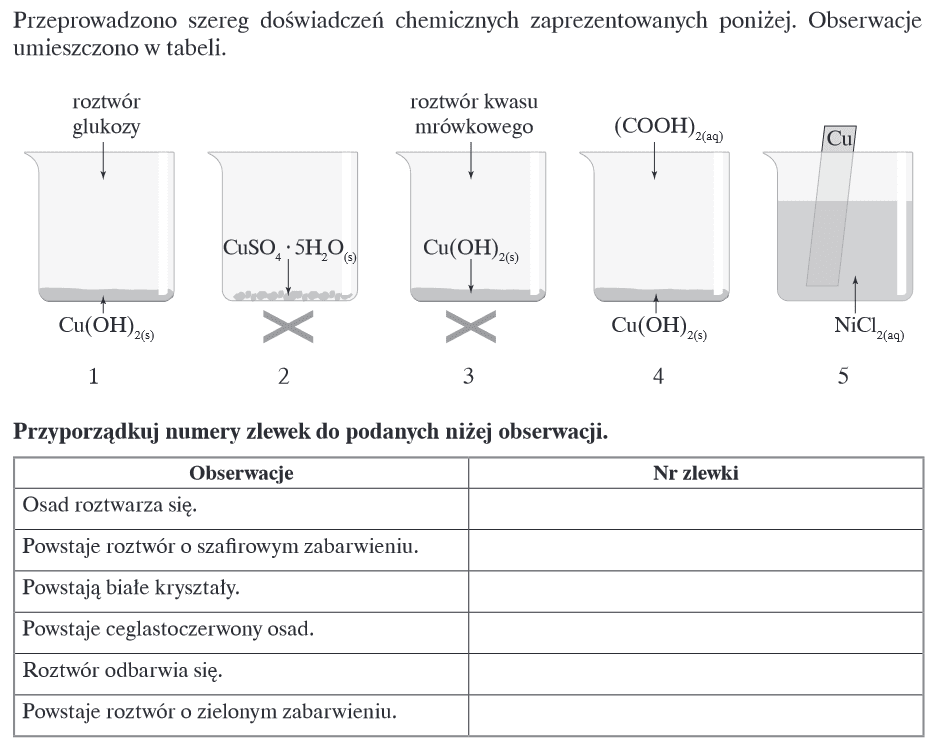
Proponowane odpowiedzi wg wydawnictwa:
Powstaje roztwór o szafirowym zabarwieniu: 1, 4
Powstaje celastoczerwony osad: 3
Odpowiedzi te są błędne. Uproszczony zapis równania reakcji nie oznacza, że można uprościć doświadczenie w probówce/zlewce. Wprowadzają one w błąd, dlatego jestem ich przeciwnikiem. W uproszczonym zapisie równania reakcji zachodzącej podczas próby Trommera pojawia się sam Cu(OH)2. Problem w tym, że sam wodorotlenek miedzi nie jest odczynnikiem Trommera. Próbę tę przeprowadza się w obecności zalkalizowanej zawiesiny świeżo wytrąconego Cu(OH)2. Z tego powodu wodorotlenek miedzi wytrąca nadmiarem zasady. O ile utlenianie wymaga obecności zasady, o tyle szafirowe roztwory także tworzą się dopiero w obecnosci zasady. A w zadaniu mamy sam Cu(OH)2. A Zatem:
Nie dostrzeglibyśmy więc powstania szafirowego koloru w zlewce 1.
W zlewce 3. dojdzie do roztworze Cu(OH)2 i powstania niebieskiego roztworu mrówczanu miedzi(II).
W zlewce 4. nie dojdzie do powstania szafirowego roztworu. Powstanie jasnoniebiski praktycznie nierozpuszczalny osad szczawianu miedzi(II):

Reakcja tworzenia szafirowych kompleksów jest charakterystyczna dla zwiazków 1,2-dihydroksylowych (1,2-dioli), a (COOH)2 nie jest związkiem dihydroksylowym (diolem), tylko dikarboksylowym (kwasem dikarboksylowym).