Hydroliza soli to jedno z pojęć obowiązkowych w materiale szkolnym. Niestety jest to jedno z najgorzej uczonych pojęć. I bardzo często po szkolnej nauce nie mamy pojęcia o hydrolizie soli. To znaczy, może inaczej: wydaje nam się, że mamy pojęcie. A potem przychodzi matura i się okazuje, że tracimy punkty. Dlaczego?
Przeanalizujemy teraz pewne zadanie maturalne i odpowiedź do niego udzieloną przez jedną osobę zdającą.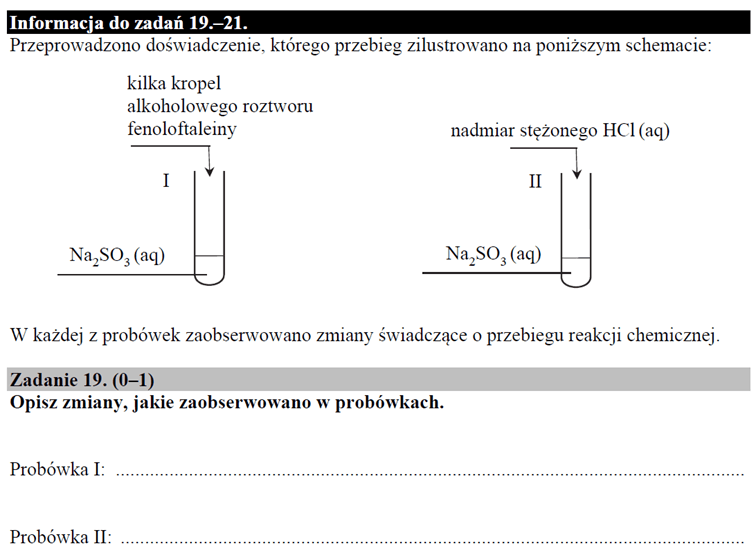
I teraz odpowiedź:

Nie jest tajemnicą, że w probówce nr I dochodzi do zjawiska hydrolizy anionowej. Osoba zdająca wiedziała o tym. Odpowiedź ta została oceniona na zero.
Jak wspomniałem o hydrolizie, jesteśmy często uczeni bardzo źle. Równania hydrolizy zapisywane są bardzo często w taki sposób:
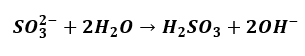
Albo i tak:
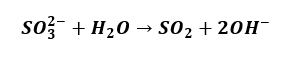
A gdybyśmy mieli zapisać równanie dysocjacji kwasu ortofosforowego(V), to co napiszemy?
Czyżby tak?
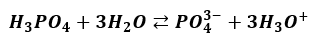
Choć na papierze się zgadza, to równanie to nie ma sensu. Ta dysocjacja zachodzi etapami. Każdy etap ma swoją stałą równowagi. W pierwszym etapie powstają jony diwodorosforanowe:
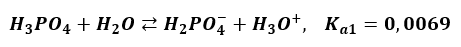
Tylko nieznaczna część anionów H2PO4- oddaje jeden ze swoich protonów dalej i tworzy aniony HPO42-. A z tych tylko niewielka część przechodzi w jony PO43-. Powoduje to, że jonów ortofosforanowych w wodnym roztworze H3PO4 praktycznie nie ma. Takie równanie:
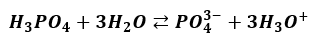
Oznaczałoby, że na 1 anion PO43- są 3 kationy H3O+ - a to nieprawda. Kationów H3O+ jest miliony razy więcej! Zwróćmy jeszcze uwagę, że pierwszy etap dysocjacji wprowadza do roztworu dużą liczbę jonów H3O+. Jony te powstają także w drugim etapie. Pierwszy etap już wprowadził dużą liczbę tych jonów. Te jony powstałe w pierwszym etapie przesuwają stan równowagi dysocjacji II etapu w lewo. I to silnie, bo stała dysocjacji drugiego etapu jest bardzo mała. Jony H2PO4- w roztworze H3PO4 dysocjują w znacznie mniejszym stopniu, niż na przykład w roztworze KH2PO4 (przy tym samym stężeniu roztworów). Zjawisko to nazywa się efektem wspólnego jonu. Jest przypadkiem działania reguły przekory.
Analogicznie jest z hydrolizą anionową, która także jest rodzajem dysocjacji. Zachodzi etapami, ponadto etap pierwszy:
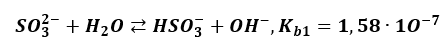
Skutecznie blokuje zajście etapu drugiego, którego stała równowagi i tak jest bardzo mała.
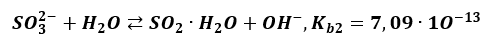
A to wszystko powoduje, że ilość SO2 w tym roztworze jest śladowa. I nie opuszcza roztworu.
Ze względu na obecnosć SO2 w powietrzu bardziej prawdopodobne jest powolne pochłanianie SO2 z powietrza przez ten roztwór.
Poza tym zastanówmy się:
1) Jaki sens miałyby obliczanie pH roztworu, z którego uwalniałby się SO2? W każdej chwili pH roztworu byłoby inne. Po pewnym czasie byłby to roztwór NaOH, a nie Na2SO3.
2) Po co jest fenoloftaleina, skoro o tym, że w roztworze dochodzi do hydrolizy wiedzieliśmy po uwalnianiu się gazu. Albo to zobaczymy, albo poczujemy… Albo wykryjemy zwilżonym uniwersalnym papierkiem wskaźnikowym umieszczonym nad roztworem... To po co używamy fenoloftaleiny?
No właśnie po to, by się przekonać, że do tej hydrolizy dochodzi. Bo wydzielania gazu nie ma. I jeśli odparujemy wodę z tego roztworu, to odzyskamy rozpuszczoną sól: Na2SO3. Gdyby uwalniał się SO2, to byłoby to niemożliwe.
Ponadto często nadużywane są równania hydrolizy z jedną strzałką: tylko w prawo. Taki zapis oznaczałby, że proces zachodzi nieodwracalnie: w 100%.
Owszem na maturze nie stracisz punktów, jeżeli w równaniu reakcji użyjesz strzałki w jedną stronę. Za samo równanie reakcji nie stracisz. Ale jeśli za tym idzie w parze wyciągnięcie błędnych wniosków, to już tak… Miałem do czynienia z sytuacją, że ktoś twierdził, że został niesprawiedliwie oceniony na maturze. Bo w roztworze Na2CO3 anionów węglanowych przecież nie ma, bo uległy hydrolizie… Zbyt często uczniowie nie mają świadomości, że hydroliza jest procesem równowagowym. I że zachodzi w niewielkim stopniu.
Tak samo nie ma wydzielania gazu z wodnych roztworów NH4Cl. Tam mamy hydrolizę kationową:
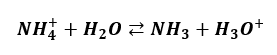
I tutaj także niektórzy twierdzą, że wydzieli się gaz (NH3). Ale przecież chlorowodór to także lotny gaz. Gdyby amoniak opuszczał ten układ, to w probówce musiałby zostać kwas solny, który jest wodnym roztworem chlorowodoru. Z kwasu solnego uwalnia się przecież gazowy chlorowodór. A zatem uwalniałyby się oba gazy.
Pozostajemy przy hydrolizie kationowej. Na polecenie zapisz równanie reakcji, w której otrzymasz wodorotlenek miedzi(II) niektórzy piszą:
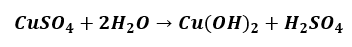
I potem pytają: „Dlaczego takiej odpowiedzi nie ma w kluczu?”, „Czy taka odpowiedź zostanie uznana na maturze?”
Wodorotlenek miedzi(II) strąca się jako niebieski galaretowaty osad, który tworzy zawiesinę. Tymczasem rozpuszczając CuSO4 w wodzie otrzymujemy klarowny roztwór, a nie zawiesinę:

A gdy w tym roztworze zanurzymy uniwersalny papierek wskaźnikowy, to się zaczerwieni:

Czy umiecie sobie już odpowiedzieć na pytanie, dlaczego?
Ponadto, nawet w roztworze CuSO4 hydroliza kationowa zachodzi etapami. Pierwszy z nich:
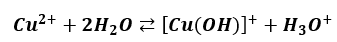
A co z drugim etapem, to już sobie spróbujcie odpowiedzieć.
Podsumowując:
Hydroliza soli to nie jest metoda otrzymywania praktycznie nierozpuszczalnych wodorotlenków, ani gazów (NH3, SO2 itp.). Hydroliza jest zjawiskiem, które pozwala nam wyjaśnić odczyn roztworu soli.
Na ogół zachodzi w bardzo małym stopniu. Możemy łatwo policzyć, że w roztworze octanu potasu o stężeniu 0,1 mol/dm3 w temp. 25 °C hydrolizie (dysocjacji zasadowej) ulega zaledwie 1 na 13400 anionów octanowych! Dlatego roztwór ten ma pH ok. 8,9, a nie 13.
Co by to oznaczało w praktyce, gdyby otrzymać jeden dm3 roztworu przez rozpuszczenie 1/10 mola od stanu sodu w wodzie, a pH roztworu wynosiłoby 13? Oznaczałoby, że kwas octowy nie reaguje z NaOH. Bo przecież powstała sól, musiałaby całkowicie przereagować z wodą i odtworzyć substraty. To co po w ogóle miałyby reagować?
A zresztą zobaczmy na ostatni arkusz maturalny:

Czy widzimy wydzielanie gazu? Po co nam ta fenoloftaleina?
PS rozpuszczajac w wodzie niektóre sole (np. FeCl3) pojawia się zmętnienie - powstają nieznaczne ilości hydroksosoli, a nie wodorotlenki.