Wszystkie zadania
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Zadanie 1
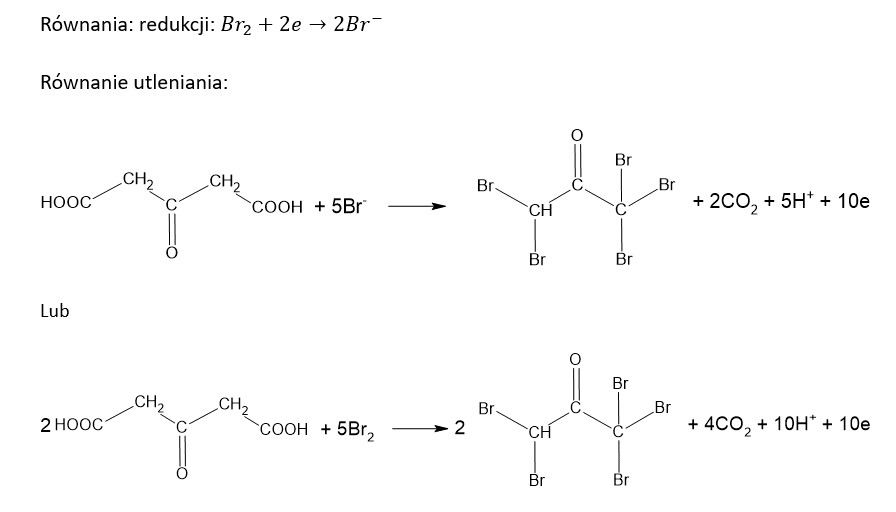
Kwas cytrynowy (kwas 2-hydroksypropano-1,2,3-trikarboksylowy) poddany działaniu wodnego roztworu KMnO4 ulega reakcji, w której zostaje przekształcony w kwas acetono-1,3-dikarboksylowy. Jednocześnie obserwuje się powstanie brunatnej zawiesiny i uwalnianie bezbarwnego gazu. Ciało stałe usuwa wprowadzając roztwór szczawianu amonu oraz rozcieńczony roztwór H2SO4 w wodzie. Na końcu, do bezbarwnego roztworu wprowadza się wodę bromową – powoduje to strącenie praktycznie nierozpuszczalnego w wodzie pentabromoacetonu i wydzielenie bezbarwnego gazu.Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji i równanie reakcji utleniania, które zaszły podczas opisanej przemiany. Uwzględnij środowisko reakcji. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
a) Po dodaniu roztworu KMnO4 do roztworu kwasu cytrynowego.
Równanie redukcji: …………………………………………………………………………………
Równanie utleniania: .......................................................................................................
b) Po wprowadzeniu roztworu szczawianu amonu i roztworu H2SO4.
Równanie redukcji: ………………………………………………………………………………………..
Równanie utleniania:
c) Po wprowadzeniu wody bromowej.Równanie redukcji: ………………………………………………………………………………………..
Równanie utleniania:
Odpowiedź:
a)
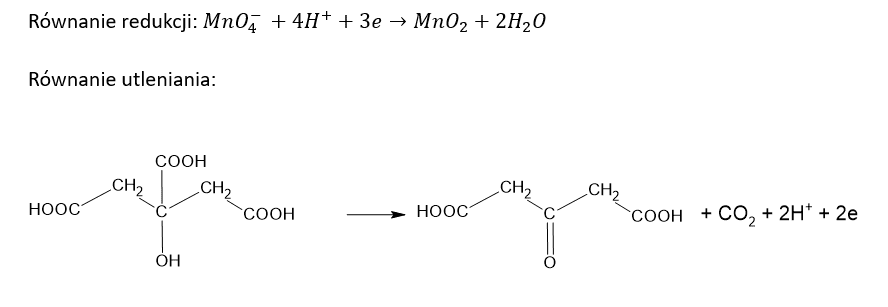
b)
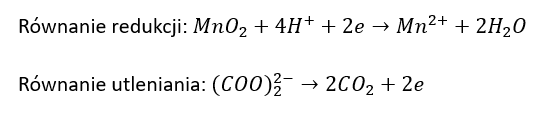
c)
UWAGA: warunkowo dopuszczalne są zapisy z jonami OH- w równaniach reakcji, w których nie uczestniczył mocny kwas.
Zadanie 2
Mieszaniu cieczy towarzyszy zjawisko kontrakcji objętości, czyli zmiana objętości układu. np. w temperaturze pokojowej po wprowadzeniu do jednego naczynia 100 cm3 etanolu i 100 cm3 czystej wody otrzymuje się ok. 194 cm3 roztworu, zamiast spodziewanych 200 cm3.
Wyjaśnij, dlaczego zjawiska zmniejszenia objętości układu nie obserwuje się po umieszczeniu w jednym naczyniu 100 cm3 n-heksanu i 100 cm3 czystej wody.
Odpowiedź:
Woda i n-heksan praktycznie nie mieszają się ze sobą. W związku z tym nie tworzą układu jednorodnego i objętość układu jest sumą objętości obu faz.
Komentarz: to zadanie było najtrudniejsze w ocenianiu, gdyż tylko nieliczne prace jasno wskazywały na niejednorodność układu. Większość odnosiła się do różnic w polarności i braku wiązań wodorowych pomiędzy cząsteczkami wody i n-heksanu. Warunkowo zaliczałem odpowiedzi, które nie wykluczały się z możliwością powstania układu heterogenicznego. Odpowiedzi, które jasno wskazywały na powstanie układu jednorodnego nie były zaliczane.
Zadanie 3
Temperatura krzepnięcia roztworów jest niższa niż temperatura krzepnięcia czystego rozpuszczalnika. Im więcej drobin wprowadzi się do danej masy rozpuszczalnika, tym niższą temperaturę krzepnięcia ma otrzymany roztwór. Zjawisko obniżenia temperatury krzepnięcia w odniesieniu do temperatury krzepnięcia czystego rozpuszczalnika nazywamy efektem krioskopowym.W dwóch zlewkach (oznaczonych jako I i II)znajdowało się po 500 g wody. Następnie do każdej wprowadzono odpowiednią ilość substancji:
Zlewka I – 0,5 mol glukozy
Zlewka II – 0,5 mol sacharozy
Zlewka III – 0,5 mol chlorku sodu
Zlewka IV – 0,5 mol siarczanu(VI) baru
Zawartość każdej zlewki zamieszano. W każdej stwierdzono obecność fazy ciekłej.Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli informacja jest prawdziwa, albo F, jeśli informacja jest fałszywa.
Roztwór w zlewce II ma niższą temperaturę krzepnięcia niż roztwór w zlewce I, ponieważ sacharoza jest dwucukrem budowanym z glukozy i fruktozy. P F Ciecz w zlewce III ma taką samą temperaturę krzepnięcia, jak ciecz w zlewce IV P F W jednym naczyniu w praktyce nie zaobserwowano efektu krioskopowego P F Odpowiedź:

Komentarz: BaSO4 jest związkiem praktycznie nierozpuszczalnym w wodzie. Z tego powodu efekt krioskopowy jest pomijalny.
Zadanie 4
Przeprowadzono dwuetapowe doświadczenie. Pierwszy etap przedstawiono poniżej:
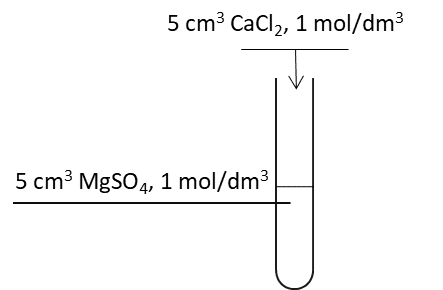
Zaobserwowano powstanie białego osadu. Zawiesinę przesączono. W etapie II do 5 cm3 przesączu dodano 5 cm3 roztworu BaCl2 o stężeniu 1 mol/dm3.
Napisz równanie reakcji zachodzącej w etapie II lub napisz, że reakcja nie zachodzi.
Odpowiedź
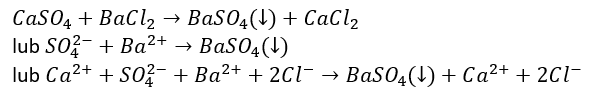
Komentarz: w temperaturze pokojowej rozpuszczalność CaSO4 wynosi ok. 0,25 g/100 g wody. Tzw. woda gipsowa (nasycony roztwór CaSO4) służy do wykrywania jonów Ba2+ strącając osad BaSO4.
Zadanie 5
Poniżej podano efekty energetyczne dwóch reakcji jonowych w stanie standardowym:NaOH(aq) + HCl(aq) → NaCl(aq) + H2O + 55,8 kJ
Ba(NO3)2(aq) + Na2SO4(aq)→ BaSO4(s) + 2NaNO3(aq) + 26,3 kJ
Przeprowadź obliczenia i na podstawie powyższych danych oszacuj standardową entalpię reakcji o podanym równaniu:
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + 2H2O(c)
Odpowiedź
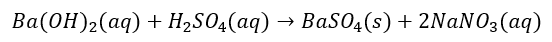
Wartość przybliżona – aby otrzymać poprawny wynik należy jeszcze uwzględnić efekt dysocjacji jonów HSO4- na jony SO42-.
Zadanie 6
Kwas cytrynowy jest kwasem trójprotonowym. Z przesyconych roztworów kwasu cytrynowego (C6H8O7) w wodzie wypadają kryształy o wzorze C6H8O7·xH2O. W celu ustalenia współczynnika x próbkę kryształów o masie 1,211 g (otrzymanych z wodnego roztworu) rozpuszczono w wodzie i miareczkowano roztworem NaOH w obecności fenoloftaleiny. Do pojawienia się trwałego różowego zabarwienia zużyto 69,2 cm3 roztworu NaOH o stężeniu 0,2500 mol/dm3.
Zadanie 6.1
Oblicz wartość współczynnika x.Zadanie 6.2
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli informacja jest prawdziwa, albo F, jeśli informacja jest fałszywa.
W opisanym hydracie kwasu cytrynowego na jedną cząsteczkę kwasu przypada jedna cząsteczkę wody, a w hydracie o wzorze CuSO4·5H2O na jedną cząsteczkę soli przypada pięć cząsteczek wody. P F Rozpuszczenie w wodzie bezwodnego kwasu cytrynowego i pozostawienie do odparowania wody prowadzi do otrzymania kryształów o wzorze C6H8O7·H2O P F Kwas cytrynowy może reagować z NaOH w stosunku molowym nkwasu : nNaOH = 1 : 1. P F Odpowiedź:
Zadanie 6.1
x = 1
Zadanie 6.2

W przeciwieństwie do kwasu cytrynowego CuSO4 nie jest związkiem cząsteczkowym. Nie można powiedzieć, że w hydracie o wzorze CuSO4·5H2O na jedną cząsteczkę soli przypada pięć cząsteczek wody.
Deuteron, d, to cząstka będąca jądrem deuteru (2H). W reakcji pomiędzy jądrem jednego ze stabilnych izotopów litu (litu-6 lub litu-7) a deuteronem, powstają jądra atomowe o tej samej liczbie masowej.
Napisz równanie opisanej przemiany. Uzupełnij wszystkie pola w poniższym schemacie.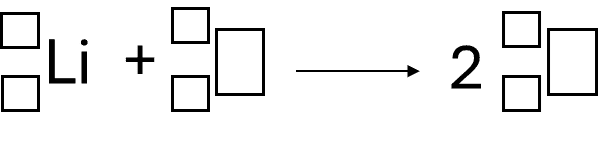
poprawna odpowiedź:
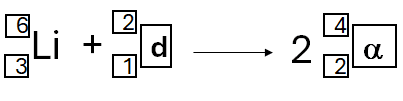
Lub
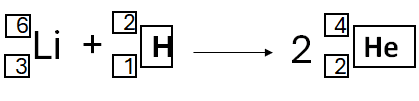
Znanych jest wiele syntetycznych radioizotopów niklu. Część z nich o niższych liczbach masowych ulega rzadziej obserwowanym typom rozpadów. Jądra atomowe niklu-48 rozpadają się wg różnych ścieżek, które zachodzą w tym samym czasie.
Zadanie 1
Jednym z produktów jest żelazo-46 oraz cząstki oznaczone umownie symbolem X.
Ustal symbol cząstki X i napisz równanie opisanej przemiany. Uzupełnij wszystkie pola w poniższym schemacie.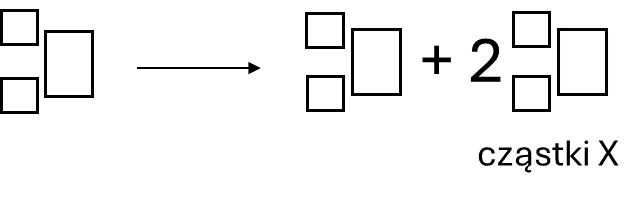
Zadanie 2
Kiedy jądro ma nadmiar protonów, w jego wnętrzu może zajść przemiana β+, w której z protonu powstają neutron, pozyton (e+ lub β+) i neutrino (ν).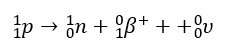
Pozyton jest cząstką różniącą się od elektronu tylko znakiem ładunku elektrycznego. Bezwzględna wartość ładunku oraz masa obydwu cząstek są jednakowe. Neutrino jest nienaładowaną elektrycznie cząstką o masie spoczynkowej bliskiej zeru.
Część jąder atomowych niklu-48 ulega rozpadowi w przemianie β+.
Napisz równanie opisanej przemiany. Uzupełnij wszystkie pola w poniższym schemacie.
Zadanie 3
Jądra atomowe trzeciego nuklidu, który powstaje w wyniku rozpadu niklu-48 ma liczbę masową równą 47. Podczas tego rozpadu emitowane są zarówno cząstki oznaczone jako X, jak i cząstki β+.
Ustal, które cząstki (cząstki oznaczone w zadaniu nr 1 jako X, cząstki β+) i w jakiej liczbie są emitowane podczas opisanej przemiany. Uzupełnij schemat, podaj symbol chemiczny oraz liczbę atomową powstającego nuklidu.Liczba cząstek X: …….
Liczba cząstek β+: …….
Zadanie 1
poprawna odpowiedź:
Cząstka X: proton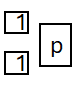
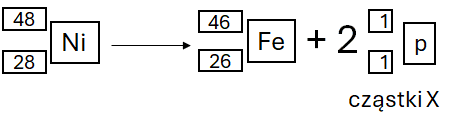
Zadanie 2
poprawna odpowiedź: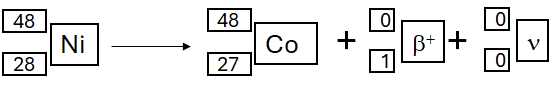
Zadanie 3
poprawna odpowiedź:
Liczba cząstek X: 1
Liczba cząstek β+: 1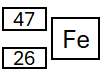
Atomy pewnego metalicznego pierwiastka oznaczonego umownie symbolem X występują naturalnie w postaci 5 izotopów o liczbach masowych: 58 (68,077% atomów), 60 (26,233% atomów), 61 (1,14% atomów), 62 (3,634% atomów) oraz 64 (0,926%).
W wyniku analizy pewnej próbki metalu X stwierdzono, że średnia ważona liczb masowych wszystkich atomów jest równa 59,142.
Zadanie 1
Wykonaj odpowiednie obliczenia i rozstrzygnij, czy analizowana próbka jest naturalnie występującą mieszaniną izotopów, czy też jest sztucznie wzbogacona w jeden z izotopów.Rozstrzygnięcie: ……………………….
Zadanie 2
Z podanego zestawu wybierz tę wartość, która przedstawia masę atomową naturalnego pierwiastka X. Podaj jego symbol.
a) 57,935 u
b) 58,693 u
c) 58,766 u
d) 59,142 u
e) 59,452 u
Symbol pierwiastka: ……….Zadanie 1
poprawna odpowiedź:
Rozstrzygnięcie: próbka jest sztucznie wzbogacona w jeden z izotopów.Zadanie 2
poprawna odpowiedź:
b) 58,693 uTlenek wapnia w sposób egzotermiczny reaguje z wodą wg równania:
CaO + H2O → Ca(OH)2
Przeprowadzono dwa doświadczenia, przedstawione na schemacie. Wszystkie składniki oraz otoczenie miały początkową temperaturę 25 °C. Temperatura otoczenia nie zmieniła się podczas doświadczenia.
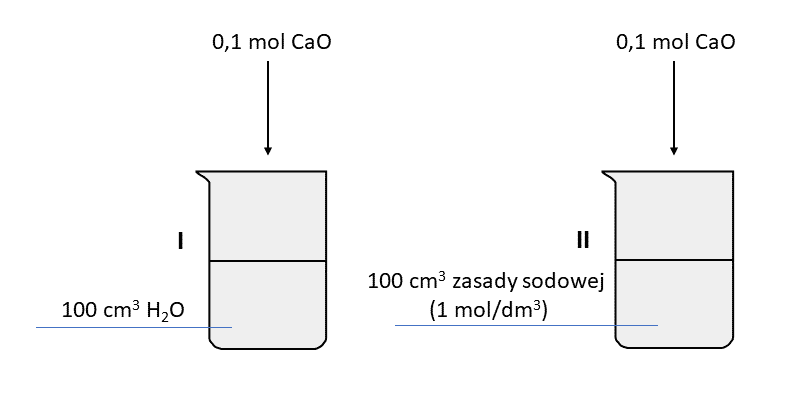
Zadanie 1
Uzupełnij zdania. Wybierz i podkreśl po jednym określeniu z nawiasu.
Po zamieszaniu zawartości temperatura układu w zlewce I była (wyższa od 25 °C / niższa od 25 °C), co oznacza, że układ (zaczął oddawać ciepło do otoczenia / przyjmować ciepło od otoczenia). Po zakończeniu zmian w zlewce I otrzymano (układ jednorodny / zawiesinę).Zadanie 2
W zlewce II zaobserwowano powstanie zawiesiny.
Wybierz zdanie, które w prawidłowo opisuje wynik doświadczenia w zlewce II.
A. W zlewce II nie doszło do zmiany temperatury, ponieważ tlenek wapnia nie reaguje z zasadą sodową.
B. Otrzymanie zawiesiny świadczy o tym, że tlenek wapnia nie reaguje z zasadą sodową.
C. W zlewce II zaszła reakcja, ale jej substraty i produkty są inne niż w zlewce I, więc efekt cieplny jest inny niż w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
D. Tlenek wapnia przereagował z zasadą sodową, a efekt cieplny jest praktycznie taki sam jak w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
Na razie się wstrzymam ;-)
Ale podam w niedługim czasie.