Zadanie z chemii z działu: undefined
Zadanie 1
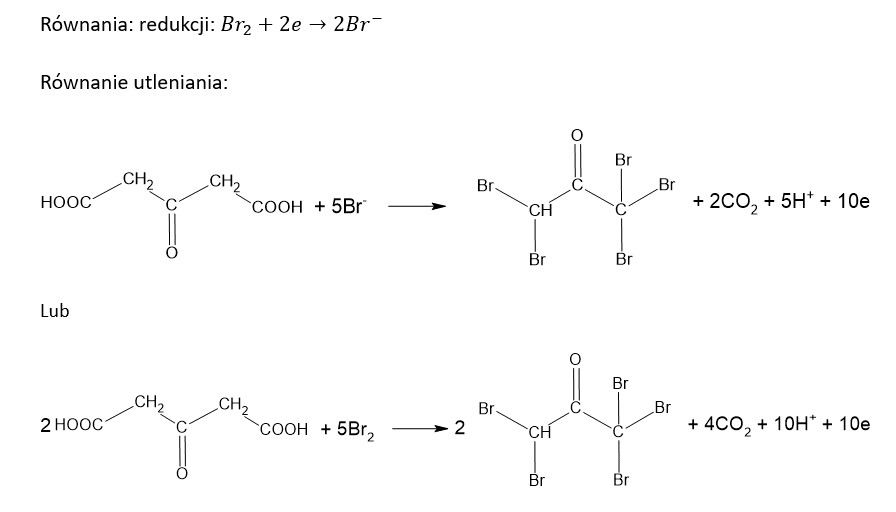
Kwas cytrynowy (kwas 2-hydroksypropano-1,2,3-trikarboksylowy) poddany działaniu wodnego roztworu KMnO4 ulega reakcji, w której zostaje przekształcony w kwas acetono-1,3-dikarboksylowy. Jednocześnie obserwuje się powstanie brunatnej zawiesiny i uwalnianie bezbarwnego gazu. Ciało stałe usuwa wprowadzając roztwór szczawianu amonu oraz rozcieńczony roztwór H2SO4 w wodzie. Na końcu, do bezbarwnego roztworu wprowadza się wodę bromową – powoduje to strącenie praktycznie nierozpuszczalnego w wodzie pentabromoacetonu i wydzielenie bezbarwnego gazu.
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji i równanie reakcji utleniania, które zaszły podczas opisanej przemiany. Uwzględnij środowisko reakcji. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
a) Po dodaniu roztworu KMnO4 do roztworu kwasu cytrynowego.
Równanie redukcji: …………………………………………………………………………………
Równanie utleniania: .......................................................................................................
b) Po wprowadzeniu roztworu szczawianu amonu i roztworu H2SO4.
Równanie redukcji: ………………………………………………………………………………………..
Równanie utleniania:
c) Po wprowadzeniu wody bromowej.
Równanie redukcji: ………………………………………………………………………………………..
Równanie utleniania:
Odpowiedź:
a)
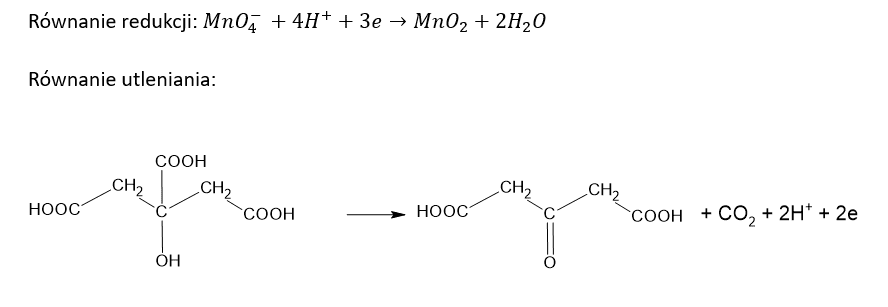
b)
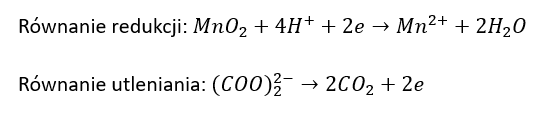
c)
UWAGA: warunkowo dopuszczalne są zapisy z jonami OH- w równaniach reakcji, w których nie uczestniczył mocny kwas.