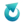Wszystkie zadania
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Tlenek wapnia w sposób egzotermiczny reaguje z wodą wg równania:
CaO + H2O → Ca(OH)2
Przeprowadzono dwa doświadczenia, przedstawione na schemacie. Wszystkie składniki oraz otoczenie miały początkową temperaturę 25 °C. Temperatura otoczenia nie zmieniła się podczas doświadczenia.
Zadanie 1
Uzupełnij zdania. Wybierz i podkreśl po jednym określeniu z nawiasu.
Po zamieszaniu zawartości temperatura układu w zlewce I była (wyższa od 25 °C / niższa od 25 °C), co oznacza, że układ (zaczął oddawać ciepło do otoczenia / przyjmować ciepło od otoczenia). Po zakończeniu zmian w zlewce I otrzymano (układ jednorodny / zawiesinę).Zadanie 2
W zlewce II zaobserwowano powstanie zawiesiny.
Wybierz zdanie, które w prawidłowo opisuje wynik doświadczenia w zlewce II.
A. W zlewce II nie doszło do zmiany temperatury, ponieważ tlenek wapnia nie reaguje z zasadą sodową.
B. Otrzymanie zawiesiny świadczy o tym, że tlenek wapnia nie reaguje z zasadą sodową.
C. W zlewce II zaszła reakcja, ale jej substraty i produkty są inne niż w zlewce I, więc efekt cieplny jest inny niż w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
D. Tlenek wapnia przereagował z zasadą sodową, a efekt cieplny jest praktycznie taki sam jak w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
Na razie się wstrzymam ;-)
Ale podam w niedługim czasie.
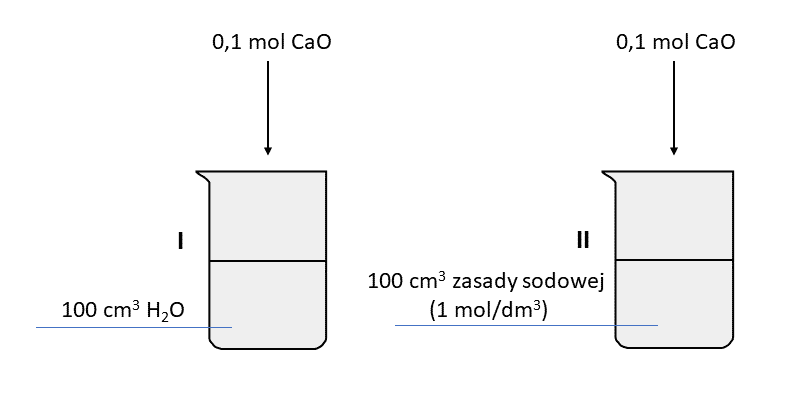
Nie uwzględniając izomerii optycznej, wyróżniamy 4 alkohole o wzorze C4H9OH (butylowe). Wszystkie w stanie ciekłym są bezbarwnymi cieczami, ale różnią się właściwościami fizycznymi. W tabeli przedstawiono wzory odpowiednich izomerów i temperatury przemian fazowych pod ciśnieniem 1013 hPa.
Zadanie 1
W szafce laboratoryjnej przechowywana jest erlenmajerka z jednym z izomerów. Erlenmajerkę po wyjęciu z szafki przedstawiono na fotografii.
Rozstrzygnij, który z alkoholi butylowych jest przechowywany w erlenmajerce. Podaj jego nazwę zwyczajową lub systematyczną. Uzasadnij swój wybór.
Nazwa: …………………………………………………..
Uzasadnienie:..................................................................................
Zadanie 2
Rozstrzygnij, czy zdanie poniżej jest prawdziwe, czy fałszywe. Wybierz i podkreśl jedno określenia z nawiasu i uzasadnij swój wybór.
Z podanych alkoholi najmniej lotny jest alkohol tert-butylowy, ponieważ ma najwyższą temperaturę topnienia.
Rozstrzygnięcie: zdanie jest (prawdziwe / fałszywe).
Uzasadnienie: .......................................................Zadanie 1
Poprawna odpowiedź:
Nazwa: alkohol tert-butylowy lub tert-butanol lub alkohol t-butylowy lub t-butanol lub 2-metylopropan-2-olUzasadnienie: najpierw poczekam na Wasze propozycje ;-)
Zadanie 2
Poprawna odpowiedź:
Rozstrzygnięcie: zdanie jest (prawdziwe / fałszywe).
Uzasadnienie: najpierw poczekam na Wasze propozycje ;-)
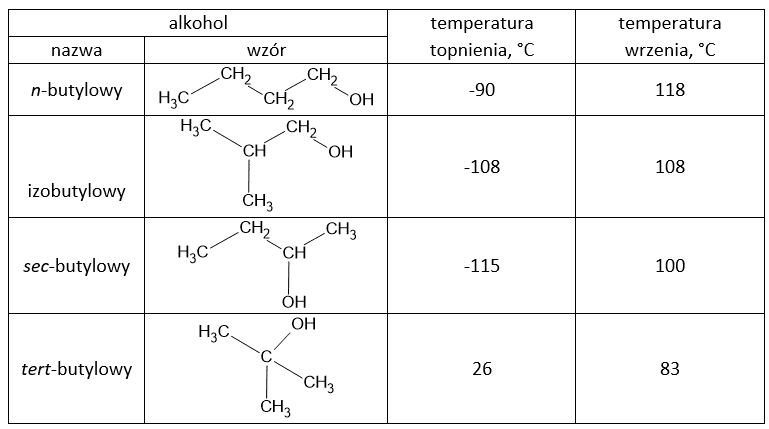
Prezentowane zadanie jest autorską propozycją jak mogłoby wyglądać zadanie nr 17 z arkusza maturalnego z 16.05.2024. Propozycja ta wynika z dyskusyjnego zachowania styrenu (w oryginalnym zadaniu 17) w prezentowanych warunkach. W tej propozycji styren zastąpiono cykloheksyloetenem.
Zadanie 17
Cykloalkany ulegają analogicznym reakcjom jak alkany.
Benzen, cykloheksan i styren to węglowodory, które w temperaturze pokojowej są bezbarwnymi cieczami. Ich wzory przedstawiono poniżej:
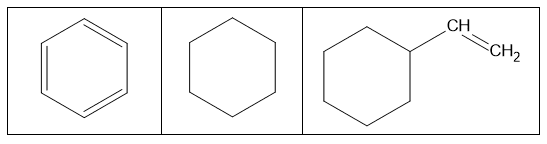
W trzech naczyniach znajdowały się oddzielnie i w przypadkowej kolejności: benzen, cykloheksan i styren. W celu identyfikacji tych substancji wykonano dwuetapowe doświadczenie. W pierwszym etapie do trzech probówek zawierających wodny roztwór manganianu(VII) potasu w środowisku obojętnym wprowadzono po jednej z badanych substancji. Następnie każdą probówkę zamknięto korkiem i wstrząśnięto. Po pewnym czasie zawartości probówek przybrały wygląd pokazany na zdjęciach.

W pierwszym etapie zidentyfikowano jeden z trzech węglowodorów. W drugim etapie doświadczenia do próbek niezidentyfikowanych węglowodorów wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) – i ogrzano zawartości probówek. Wyniki drugiego etapu doświadczenia przedstawiono na poniższych zdjęciach.
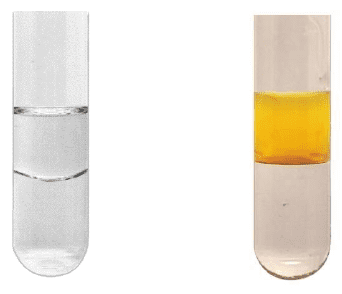
Zadanie 17.1
Napisz wzór sumaryczny związku manganu, który powstał w wyniku reakcji zachodzącej w pierwszym etapie doświadczenia, oraz wzór półstrukturalny (grupowy) lub uproszczony organicznego produktu tej przemiany.
Zadanie 17.2
Napisz równanie reakcji, która umożliwiła odróżnienie związków w drugim etapie doświadczenia.
..........................................
Zadanie 17.1
Poprawna odpowiedź: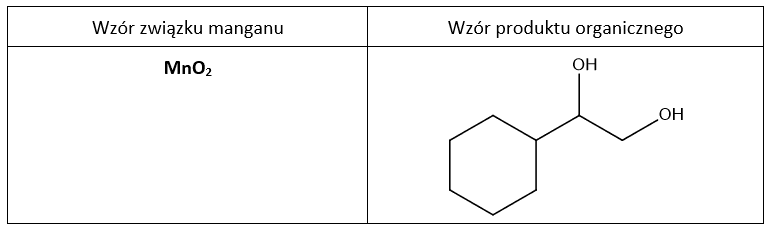
Zadanie 17.2
Poprawna odpowiedź:C6H6 + HNO3 → C6H5NO2 + H2O
Zadanie to jest autorską propozycją jak mogłoby wyglądać zadanie nr 27 z arkusza maturalnego z 16.05.2024 (F2023), aby było ono jednoznaczne
i zgodnie z właściwościami chemicznymi przedstawionych substancji.Przeprowadzono reakcje zgodnie ze schematem:
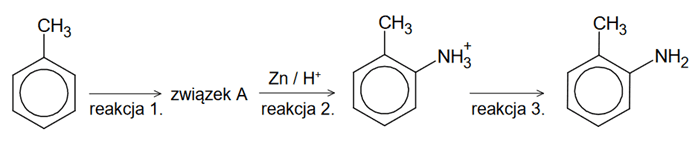
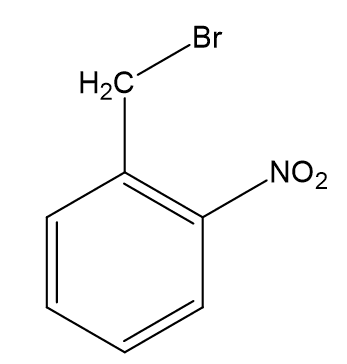
Do organicznego związku w reakcji 1. wkraplano brom w obecności światła. Wkraplanie przerwano, gdy osiągnięto stosunek molowy substancji 1 : 1.
Zadanie 27
Narysuj wzór półstrukturalny lub uproszczony organicznego produktu opisanej reakcji i uzupełnij zdanie. Wybierz i zaznacz właściwą odpowiedź spośród podanych w nawiasie.
Opisana przemiana (jest / nie jest) reakcją utlenienia-redukcji.
Komentarz autora: informacja do zadania w oryginalnym brzmieniu mówi o produkcie reakcji 3 (2-metyloaniliny) i jego dalszej reakcji z bromem. Niestety, ale obecność grupy -NH2 związanej z pierścieniem aromatycznym silnie aktywuje pierścień w reakcjach substytucji elektrofilowe (anilina w reakcji z wodą bromową daje prawie natychmiast osad 2,4,6-tribromoaniliny - bez żadnych katalizatorów). Z tego też powodu zmieszanie z bromem może doprowadzić do bardzo gwałtownej reakcji (a nawet wybuchu) po zmieszaniu reagentów i bez udziału światła. Finalnym produktem powinna być 2,4-dibromo-6-metyloanilina, a w przypadku stosunku molowego 1 : 1 mieszanina 2,4-dibromo-6-metyloaniliny, 2-bromo-6-metyloaniliny i 4-bromo-6-metyloaniliny. Grupa -NO2 jest podstawnikiem bardzo silnie dezaktywujacym pierścień aromatyczny - po zmieszaniu w bromem reakcja powinna zajść dopiero przy naświetlaniu, analogicznie jak w przypadku bromowania toluenu na świetle. Związek taki pojawia się jako związek A (produkt reakcji 1).
Poprawna odpowiedź:
Opisana przemiana (jest / nie jest) reakcją utlenienia-redukcji.
Zadanie z kwasem mrówkowym i próbą Trommera, jakie mogłoby pojawić się na maturze 😊
Przypominam też, że NIE MUSICIE WIEDZIEĆ, CZY KWAS MRÓWKOWY ULEGA PRÓBIE TROMMERA ALBO TOLLENSA. MACIE TYLKO WIEDZIEĆ, ŻE KWAS TEN MA (WOBEC SILNYCH UTLENIACZY) WŁAŚCIWOŚCI REDUKUJĄCE. Dalsze informacje dla tegorocznych maturzystów znajdują się pod treścią zadania.
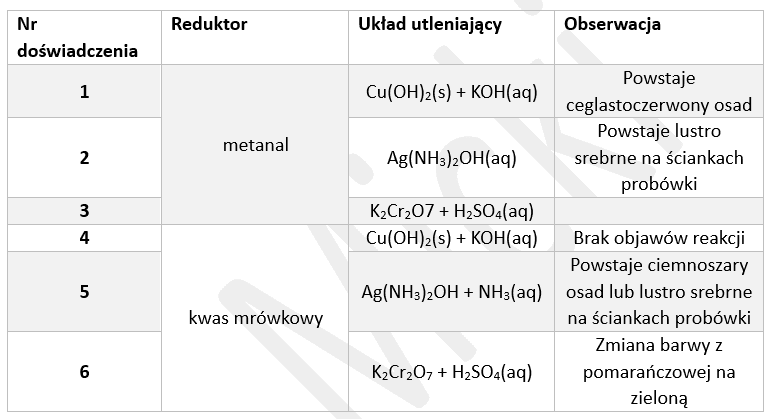
Przeprowadzono serię doświadczeń, w których porównywano zachowanie dwóch reduktorów organicznych: metanalu i kwasu metanowego (mrówkowego) wobec różnych utleniaczy w wodnym środowisku: roztwór wodorotlenku diaminasrebra i zalkalizowana zawiesina wodorotlenku miedzi(II). W doświadczeniach nr 4 i 5 użyto takiej ilości zasady, by dodany kwas metanowy nie spowodował zmiany odczynu mieszaniny reakcyjnej na obojętny lub kwasowy. Wyniki doświadczenia przedstawiono w tabeli. Pewne miejsce pozostawiono jednak puste, a w pozostałych przypadkach podano niektóre z objawów reakcji.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno wyrażenie z podanych w nawiasach.
Można stwierdzić, że metanal ma (silniejsze / słabsze) właściwości redukcyjne, niż kwas metanowy. W zasadowym środowisku, spośród Cu(OH)2(s) i [Ag(NH3)2]+ silniejszym utleniaczem jest ten (pierwszy / drugi). Na podstawie wyniku doświadczenia nr 6 można stwierdzić, że roztwór reakcyjny w doświadczeniu nr 3 (pozostał pomarańczowy / zmienił barwę z pomarańczowej na żółtą / zmienił barwę z pomarańczowej na zieloną). Uwalnianie się bezbarwnego gazu zaobserwowano w doświadczeniu nr 6. Gaz ten (powstawał także / nie powstawał) w doświadczeniu nr 5.
********************************************
W 2015 roku pojawiło się zadanie dotyczące zachowania kwasu mrówkowego w próbie Trommera. Z INFORMACJĄ WSTĘPNĄ, bo jak piszę - nigdy nie było w wymaganiach, by znać zachowanie tego kwasu w próbie Trommera czy Tollensa. Takie zadanie już więcej się nie pojawiło, ponieważ:
w CKE juz od dawna wiedzą, że kwas ten nie ulega próbie Trommera,
dawniej maturę przygotowywano na podstawie informacji z podręczników szkolnych (którymi zresztą żyje większość chemików). Obecnie treści te są bardziej weryfikowane i jest coraz mniej bubli na maturze, a pewnych rzeczy NIE MA JUŻ WCALE NA maturze z chemii. Bo wiadomo, że były błędne, że pewne rzeczy w podręcznikach są błędne. I nie jest ich mało,
informacja do zadania z 2015 była błędna: oparta na podręcznikowych przekłamaniach, ponadto opis był niezgodny z procedurą przeprowadzania próby Trommera - taki jak do dziś serwują podręczniki szkolne,
Jeśli sami porównacie nowsze i starsze arkusze, to sami zauważycie sporą różnicę w opisach próby Trommera i Tollensa w treści zadań.
No dobra, ale to, że zadanie z 2015 roku było bublem i więcej takowego nie będzie. Ale to nie oznacza, że o ten kwas w ogóle nie będą pytać. Że nie będzie jakiegoś redoksa albo czegoś innego z tym kwasem. Rok temu wymyśliłem takie zadanie, które ma pokazać, jakich zadań co do HCOOH możnaby się spodziewać po skorygowaniu wiadomości co do zachowania się HCOOH.
To, że się dowiedzieli o tym, że HCOOH nie ulega próbie Trommera nie spowodowało, że system egzaminowania padł, a w CKE wszyscy poszli z torbami. Nie po raz pierwszy informacja dotycząca czegoś nie pokrywa się z jakimś starszym arkuszem. Dlatego uważam, że ze zbiorów zadań bazujących na kopiuj+wklej z arkuszy CKE należy pewne zadania powywalać, bo dziś wprowadzają w błąd i są źródłem zamieszania. Tak więc to, że raz palnęli: "HCOOH ulega próbie Trommera" nie oznacza, że "na maturze piszemy, że HCOOH ulega próbie Trommera". A co zrobicie, jak serio dostaniecie takie zadanie podobne do tego? Odpowiecie sprzecznie z podaną infomacją do zadania, bo na maturze piszemy że... Czy raczej wywnioskujecie coś z tej informacji?
A jeśli ktoś będzie miał zagwozdkę "dlaczego takie odpowiedzi?" to niech sobie spróbuje zapisać równanie albo chociaż schemat reakcji - z uwzględnieniem środowiska, w którym ta reakcja zachodzi ☺
poprawna odpowiedź:
Można stwierdzić, że metanal ma (silniejsze / słabsze) właściwości redukcyjne, niż kwas metanowy. W zasadowym środowisku, spośród Cu(OH)2(s) i [Ag(NH3)2]+ silniejszym utleniaczem jest ten (pierwszy / drugi). Na podstawie wyniku doświadczenia nr 6 można stwierdzić, że roztwór reakcyjny w doświadczeniu nr 3 (pozostał pomarańczowy / zmienił barwę z pomarańczowej na żółtą / zmienił barwę z pomarańczowej na zieloną). Uwalnianie się bezbarwnego gazu zaobserwowano w doświadczeniu nr 6. Gaz ten (powstawał także / nie powstawał) w doświadczeniu nr 5.
W laboratorium, w którym panowała temperatura 21 °C, przygotowano wodny roztwór NH4NO3 w następujący sposób. Stały NH4NO3 i wodę demineralizowaną (oczyszczoną) ogrzano od temperatury otoczenia do 80 °C. Następnie substancje przeniesiono do umieszczonej na stole laboratoryjnym zlewki i zamieszano. Sól uległa całkowitemu rozpuszczeniu. Stwierdzono, że tuż po rozpuszczeniu soli otrzymany roztwór ma temperaturę 65 °C.
Oceń poprawność poniższych zdań. Zaznacz P, jeśli informacja jest prawdziwa, albo F, jeśli jest fałszywa.
Rozpuszczanie azotanu(V) amonu w wodzie jest procesem endotermicznym P F W czasie wykonanego doświadczenia układ pobrał ciepło od otoczenia P F poprawna odpowiedź:
Rozpuszczanie azotanu(V) amonu w wodzie jest procesem endotermicznym P F W czasie wykonanego doświadczenia układ pobrał ciepło od otoczenia P F Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Celem doświadczenia było odróżnienie dwóch, oznaczonych umownie literami X i Z, metali, z których wykonano płytki. Wiadomo, że jednym metalem był cynk, a drugim – nikiel.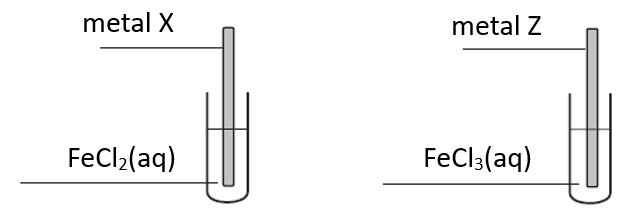
Po pewnym czasie płytki wyjęto z roztworów i osuszono. Zważono płytkę wykonaną z metalu X i stwierdzono, że masa tej płytki uległa zmianie.
Zadanie 1
Uzupełnij poniższe zdania. Wybierz i zaznacz właściwe określenie spośród podanych w każdym nawiasie oraz napisz w formie jonowej skróconej równanie zachodzącej reakcji.
Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła), a podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem:
.................................................................................................
Metalem Z był (cynk / nikiel).
Zadanie 2
Rozstrzygnij, czy do odróżnienia metali od siebie wystarczająca jest informacja, że masa płytki wykonanej z metalu X uległa zmianie. Wybierz po jednym określeniu z każdego nawiasu.
Odróżnienie metali na podstawie tej informacji (jest / nie jest) możliwe, ponieważ w czasie trwania doświadczenia masa płytki wykonanej z metalu Z się (także się zmniejszyła / także się zwiększyła / nie uległa zmianie). W naczyniu, w którym umieszczona była płytka z metalu Z (sól żelaza pozostała niezmieniona / powstała inna sól żelaza / powstało metaliczne żelazo).
poprawna odpowiedź:
Zadanie 1
Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła).
Podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem:
Zn + Fe2+ → Zn2+ + Fe
Metalem Z był (cynk / nikiel).
W tym samym czasie masa płytki wykonanej z metalu Z się (zmniejszyła / zwiększyła / nie uległa zmianie).
Zadanie 2
Odróżnienie metali na podstawie tej informacji (jest / nie jest) możliwe, ponieważ w czasie trwania doświadczenia masa płytki wykonanej z metalu Z się (także się zmniejszyła / także się zwiększyła / nie uległa zmianie). W naczyniu, w którym umieszczona była płytka z metalu Z (sól żelaza pozostała niezmieniona / powstała inna sól żelaza / powstało metaliczne żelazo).Przyjmuje się, że elektrolity dzielimy na słabe (a < 5%), średnie mocy (5% ≤ a <30%) i mocne (a>30%). W dwóch zlewkach (oznaczonych umownie A i B) umieszczono po 100 g czystej wody (pozbawionej CO2 i innych gazów wpływających na jej pH) umieszczono po 1 g odpowiedniej substancji:
A – 1 g Ca(OH)2 (M = 74 g∙mol-1)
B – 1 g kwasu benzoesowego (benzenokarboksylowego, M = 122 g∙mol-1)Zawartość zlewek zamieszano. W obu naczyniach stwierdzono, że nie otrzymano układu jednorodnego. Po opadnięciu ciała stałego na dno pobrano próbki cieczy znad osadu do badań i otrzymano następujące wyniki:
Związek
masa substancji rozpuszczonej w g na 100 cm-3 roztworu
(25 °C)
pH roztworu (25 °C)
Ca(OH)2
0,16
12,65
kwas benzoesowy
0,34
2,88
Zadanie 1
Poniżej podano kilka wartości procentowych. Wybierz i podkreśl tę wartość, która może odpowiadać stopniowi dysocjacji wodorotlenku wapnia.<5% • 17% • 34% • ≈100%
Zadanie 2
Dokończ zdania. Wybierz po jednym określeniu z każdego nawiasu.
Wodorotlenek wapnia oraz kwas benzoesowy są związkami (dobrze rozpuszczalnymi / nieznacznie rozpuszczalnymi) w wodzie. Wodorotlenek wapnia tworzy w wodzie (słaby / mocny) elektrolit gdyż jest (zdysocjowany praktycznie całkowicie / zdysocjowany nieznacznie / rozpuszczalny nieznacznie). Kwas benzoesowy tworzy w wodzie (mocny / słaby elektrolit), ponieważ jest nieznacznie (zdysocjowany / rozpuszczalny).
Zadanie 1
Poprawna odpowiedź:
<5% • 17% • 34% • ≈100%Zadanie 2
Poprawna odpowiedź:
Wodorotlenek wapnia oraz kwas benzoesowy są związkami (dobrze rozpuszczalnymi / nieznacznie rozpuszczalnymi) w wodzie. Wodorotlenek wapnia tworzy w wodzie (słaby / mocny) elektrolit gdyż jest (zdysocjowany praktycznie całkowicie / zdysocjowany nieznacznie / rozpuszczalny nieznacznie). Kwas benzoesowy tworzy w wodzie (mocny / słaby elektrolit), ponieważ jest nieznacznie (zdysocjowany / rozpuszczalny).Do 100 g chemicznie czystej wody wsypano 50 g K2SO4 i zamieszano. Rozpuszczalność K2SO4 w temperaturze wykonania doświadczenia wynosi 11,1 g na 100 g H2O.
Zadanie 1:
Oblicz masę kryształów pozostających w równowadze z roztworem nasyconym i stopień dysocjacji K2SO4.
Zadanie 2:
Dokończ zdania. Wybierz po jednym określeniu z każdego nawiasu.
Wprowadzenie do nasyconego roztworu K2SO4 stałego K2CO3 spowoduje zmniejszenie (wydajności dysocjacji / stopnia dysocjacji / rozpuszczalności) K2SO4. Jest to spowodowane wprowadzeniem dodatkowych (jonów K+ / jonów OH- ze względu na hydrolizę). Zjawisko to nosi nazwę (iloczynu rozpuszczalności / efektu wspólnego jonu).
Zadanie 1:
Poprawna odpowiedź:
mkryszt = 38,9 g
α = 100%
Zadanie 2:
Wprowadzenie do nasyconego roztworu K2SO4 stałego K2CO3 spowoduje zmniejszenie (wydajności dysocjacji / stopnia dysocjacji / rozpuszczalności) K2SO4. Jest to spowodowane wprowadzeniem dodatkowych (jonów K+ / jonów OH- ze względu na hydrolizę). Zjawisko to nosi nazwę (iloczynu rozpuszczalności / efektu wspólnego jonu).Cyjanowodór bardzo dobrze rozpuszcza się w wodzie i w niewielkim stopniu ulega dysocjacji
jonowej zgodnie z równaniem:HCN + H2O ⇄ H3O+ + CN-
Wodny roztwór cyjanowodoru nosi nazwę kwasu cyjanowodorowego. W temperaturze 25 °C
stała dysocjacji tego kwasu Ka = 6,2 10-10.
Do probówki zawierającej wodny roztwór wodorowęglanu NaCN wprowadzono – pod wyciągiem, gazowy CO2. Przebieg doświadczenia przedstawiono na rysunku.
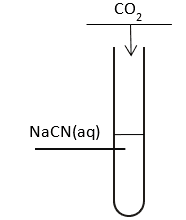
Napisz w postaci cząsteczkowej równanie zachodzącej reakcji zachodzącej podczas wykonywanego doświadczenia.
Poprawna odpowiedź:
CO2 + H2O + NaCN → NaHCO3 + HCN(↑)