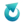Zadania z działu: Chemia fizyczna
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Sekcja laboratoryjna miała za zadanie otrzymać układy o odczynie obojętnym. W tym celu wykonano serię doświadczeń, których schematy przedstawiona na rysunku.
Wybierz numery wszystkich probówek, w których uniwersalny papierek wskaźnikowy zanurzony w mieszaninie poreakcyjnej wskaże odczyn obojętny.
Numery probówek……………………………………………………………………Poprawna odpowiedź:
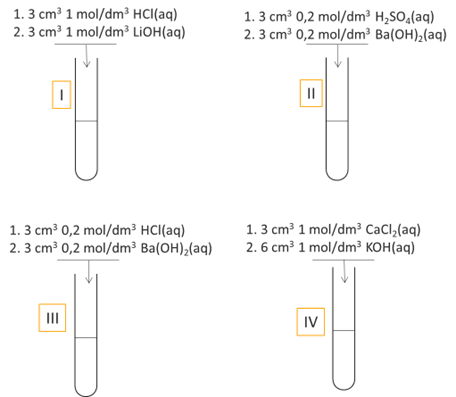
I i IIPolialkohol winylowy i polietylenoimina są polimerami, których wzory przedstawiono poniżej.
Cechą charakterystyczną obu polimerów jest dobra rozpuszczalność w wodzie. W probówkach oznaczonych numerami I i II znajdują się (w losowej kolejności) roztwory wodne obu polimerów. Roztwór każdego polimeru w osobnej probówce.
Zadanie 1
Zaprojektuj doświadczenie, które pozwoli odróżnić od siebie zawartość probówek. Wpisz nazwę jednego odczynnika wybranego z listy, który wprowadzony do obu probówek pozwoli zidentyfikować roztwory i napisz jaka obserwacja pozwoli odróżnić od siebie roztwory.
a) woda siarkowodorowa, b) alkoholowy roztwór fenoloftaleiny, c) wodny roztwór NaOH, d) woda wapienna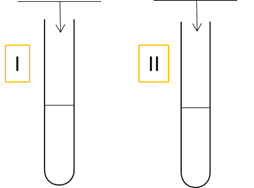
Obserwacja:…………………………………………….
Zadanie 2
Napisz równanie równowagi ustalającej się w wodnym roztworze polimeru, która umożliwia odróżnienie roztworu tego polimeru od roztworu drugiego polimeru wybranym odczynnikiem. W równaniu reakcji użyj fragmentu wzoru łańcucha polimerowego odpowiadający jednemu merowi.
Równanie reakcji:……………………………
Poprawna odpowiedź:
Zadanie 1
a) woda siarkowodorowa, b) alkoholowy roztwór fenoloftaleiny, c) wodny roztwór NaOH, d) woda wapienna
Obserwacja: W probówce, w której obecny jest roztwór polietylenoiminy roztwór przyjmuje różowe/malinowe zabarwienie. W drugiej probówce zawartość pozostaje bezbarwna.Zadanie 2
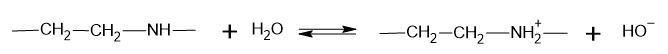
Na2SO3 jest solą słabego kwasu z mocną zasadą. W wodnych roztworach dochodzi do hydrolizy anionowej. W probówce przygotowano roztwór Na2SO3 przez zadanie 1 g Na2SO3 wodą destylowaną w ilości 5 cm3 i wstrząśniecie do całkowitego rozpuszczenia się związku.
Z podanego zestawu wybierz i zaznacz wszystkie obserwowane doświadczalnie zjawiska świadczące o równowadze ustalającej się w roztworze tej soli.
a) z roztworu uwalnia się gaz o drażniącym i duszącym zapachu,
b) po dodaniu kropli alkoholowego roztworu fenoloftaleiny do zawartość probówki przyjmuje różowe zabarwienie
c) w probówce wytrąca się galaretowaty biały osad
d) uniwersalny papierek wskaźnikowy umieszczony w roztworze przyjmuje czerwone zabarwienie
Poprawna odpowiedź:
a) z roztworu uwalnia się gaz o drażniącym i duszącym zapachu,
b) po dodaniu kropli alkoholowego roztworu fenoloftaleiny do zawartość probówki przyjmuje różowe zabarwienie
c) w probówce wytrąca się galaretowaty biały osad
d) uniwersalny papierek wskaźnikowy umieszczony w roztworze przyjmuje czerwone zabarwienieŁatwość (szybkość) podstawienia atomów wodoru w inicjowanej światłem reakcji alkanów z chlorem lub bromem zależy od rzędowości atomów wodoru. Ponadto, udział poszczególnych produktów zależy od liczby równocennych atomów wodoru w cząsteczce alkanu. W reakcji monochlorowania propanu w temperaturze pokojowej powstaje 1-chloropropan w ilości 44% i 2-chloropan w ilości 56%. Miarą łatwości ulegania podstawieniu są tzw. współczynniki reaktywności atomów wodoru. Aby wyznaczyć współczynniki reaktywności udział poszczególnego produktu dzieli się przez liczbę równocennych atomów wodoru, których podstawienie prowadzi do otrzymania tego produktu. Np. w reakcji monochlorowania propanu:
Grupa
Liczba równocennych atomów wodoru
Udział produktu
Względna szybkość podstawienia pojedynczego atomu wodoru
–CH3
6
44%
0,44/6 = 0,0733
–CH2–
2
56%
0,56/2 = 0,28
Dzieląc otrzymane wartości przez mniejszą z nich otrzymujemy współczynniki reaktywności:
Dla pierwszorzędowych atomów wodoru: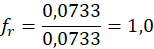
Dla drugorzędowych atomów wodoru:
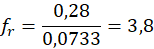
Oznacza to, że podstawienie atomu wodoru z grupy CH2 zachodzi 3,8 razy łatwiej (szybciej), niż podstawienie atomu wodoru w grupie CH3.
W tabeli zebrano współczynniki reaktywności atomów wodoru w temperaturze pokojowej w zależności od rzędowości atomu węgla, z którym są związane.Rzędowość atomu węgla
I
II
III
Współczynnik reaktywności
1,0
3,8
5,0
Zadanie 1
Na podstawie obliczeń rozstrzygnij, który z izomerów butanu poddano monochlorowaniu w temperaturze pokojowej, jeśli otrzymano dwie pochodne w ilościach 36% i 64%. Napisz jego nazwę systematyczną.Nazwa:……………………….
Zadanie 2
W tabeli zebrano dane o współczynnikach reaktywności atomów wodoru w reakcji monobromowania w temperaturze 400 K. Tabela nie zawiera kompletu danych.Rzędowość atomu węgla
I
II
III
Współczynnik reaktywności
1,0
1600
Przeprowadzono reakcję monobromowania propanu w temperaturze 400 K. Stwierdzono, że 1-bromopropan stanowi 3,5% produktów, a resztę 2-bromopropan.
Oblicz współczynnik reaktywności atomu wodoru związanego z drugorzędowym atomem węgla. Wynik podaj w zaokrągleniu do całości.
fr =……….
Zadanie 1
poprawna odpowiedź:
I sposób
Możliwości są dwie: n-butan i izobutan. Gdyby izomerem był n-butan:
6 równocennych atomów wodoru w grupach metylowych → 6 · 1 = 6
4 równocenne atomy wodoru w grupach metylenowych → 4 · 3,8 = 15,2
1-chlorobutan powstałby w ilości: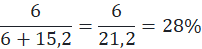
Nie odpowiada żadnej z danych wartości → izomerem był izobutan.
Nazwa: 2-metylopropan
II sposób
Możliwości są dwie: n-butan i izobutan. Gdyby izomerem był izobutan:
9 równocennych atomów wodoru w grupach metylowych → 9 · 1,0 = 9
1 atom wodoru związany z III-rzędowym atomem węgla → 1· 5,0 = 5
1-chloro-2-metylopropan powstałby w ilości: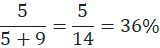
Zatem chlorowanym izomerem był izobutan.
Nazwa: 2-metylopropan
Zadanie 2
poprawna odpowiedź:
2-bromopropan stanowi 96,5% produktów.
6 równocennych atomów wodoru w grupach metylowych → 3,5%
0,035:6=0,00583
2 równocennych atomy wodoru w grupie metylenowej → 96,5%
0,965:2=0,4825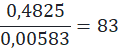
fr = 83
UWAGA: wynik zależny od przyjętych zaokrągleń!
W celu otrzymania propanalu zaplanowano przeprowadzić reakcję, którą opisuje równanie stechiometryczne:
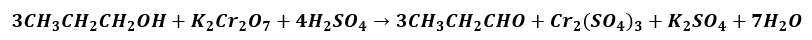
W metodzie tej stosuje się wodny zakwaszony roztwór K2Cr2O7. Ze względu na podatność aldehydu na dalsze utlenianie do kwasu karboksylowego stosuje się nadmiar alkoholu. Z mieszaniny poreakcyjnej łatwo wydzielić aldehyd metodą destylacji, więc reakcję przeprowadza się w odpowiedniej aparaturze. Jeden z odczynników podawany jest z wkraplacza po kropli do kolby reakcyjnej, w której znajduje się mieszany drugi odczynnik. Napisz, który zestaw jest prawidłowo zaplanowany, by wydajność otrzymywania aldehydu była jak najwyższa? Uzasadnij swój wybór.
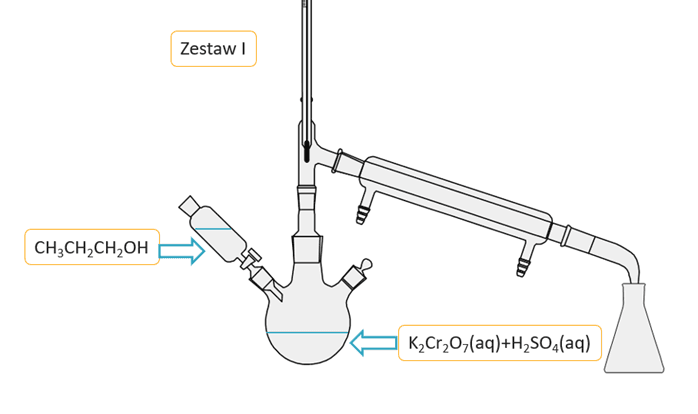
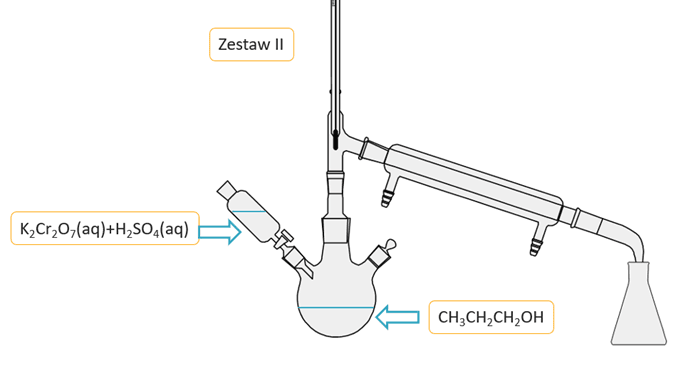
Zestaw:........
Uzasadnienie:...........
poprawna odpowiedź:
Zestaw: II
Uzasadnienie: W drugim zestawie alkohol jest cały czas w dużym nadmiarze w stosunku do dodawanego kroplami utleniacza. W zestawie I jest na odwrót.Pierwsza entalpia rozpuszczania to efekt cieplny towarzyszący rozpuszczeniu 1 mola substancji w dużej objętości rozpuszczalnika. W tabeli zestawiono dane o pierwszej entalpii rozpuszczania halogenków baru w wodzie w temperaturze pokojowej (291 K).
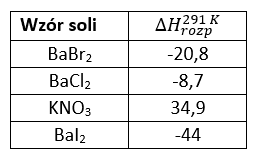
Przygotowano naważki zawierające po 1 mol z każdej soli, oraz 4 zlewki zawierające po 1 dm3 wody destylowanej. Temperatura wszystkich substancji wynosiła 291 K. Następnie do każdej zlewki wprowadzono po 1 molu danej soli i zamieszano. W każdej zlewce otrzymany roztwór miał temperaturę inną od 291 K.
Uszereguj otrzymane roztwory wg ich temperatury. Wpisz wzory odpowiednich soli w tej kolejności, jaka odpowiada rosnącej temperaturze ich roztworów.
Poprawna odpowiedź
KNO3, BaCl2, BaBr2, BaI2
W temperaturze pokojowej kwas octowy jest cieczą, która w nieograniczonym stopniu miesza się z etanolem. Kwas salicylowy (C7H6O3) jest krystalicznym ciałem stałym w temperaturze poniżej 159 °C. Jest bardzo dobrze rozpuszczalny w etanolu (stężenie nasyconego roztworu w temp. 50 °C wynosi ok. 45%). Badano równowagę reakcji estryfikacji etanolu w reakcji z kwasem octowym oraz równowagę estryfikacji etanolu w reakcji z kwasem salicylowym. Powstające estry i woda mieszają się z pozostałymi składnikami układu. Przygotowano dwa zestawy reakcyjne. W pierwszym zestawie: w kolbie reakcyjnej umieszczono 20 g kwasu octowego i 80 g etanolu. W drugim zestawie: w kolbie reakcyjnej umieszczono 20 g kwasu salicylowego i 80 g etanolu. Oba zestawy doprowadzono do odpowiedniej temperatury i wprowadzono po 0,5 cm3 st. H2SO4.
Zadanie 1
Uzupełnij tabelę. Wpisz homogeniczny lub heterogeniczny w odpowiednie pola.
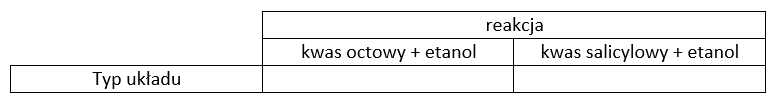
Członkowie studenckiej sekcji laboratoryjnej literami A i B oznaczyli zapisane przez siebie wyrażenia na stałą równowagi estryfikacji kwasu salicylowego z etanolem. Wzór C9H10O3 oznacza ester.
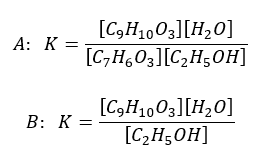
Jako prawidłowo zapisane wyrażenie studenci wybrali B, ponieważ kwas salicylowy jako jedyny reagent jest ciałem stałym w temperaturze prowadzenia procesu.
Zadanie 2
Rozstrzygnij, czy studenci dokonali prawidłowego wyboru. Uzasadnij swój wybór.Rozstrzygnięcie: ………………………………………
Uzasadnienie: …………………………………………
Zadanie 1
poprawna odpowiedź:
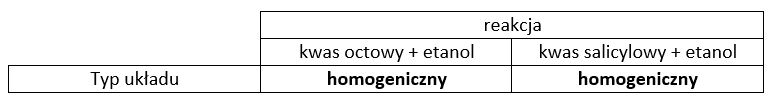
Zadanie 2
poprawna odpowiedź:
Rozstrzygnięcie: Nie
Uzasadnienie: układ reakcyjny jest jednorodny, zatem kwas salicylowy jest rozpuszczony i jego stężenie zmienia się w czasie reakcji.
Wybierz i zaznacz wszystkie przypadki, w których można otrzymać bufor fosforanowy, w którym sprzężoną parę kwas-zasada stanową wodoroaniony kwasu fosforowego(V).
A. NaH2PO4 + K2HPO4
B. NaHPO4 + Na3PO4
C. NaH2PO4 + Na2HPO4
D. NaH2PO4 + Na3PO4
E. H3PO4 + NaH2PO4Poprawna odpowiedź:
A. NaH2PO4 + K2HPO4
B. NaHPO4 + Na3PO4
C. NaH2PO4 + Na2HPO4
D. NaH2PO4 + Na3PO4
E. H3PO4 + NaH2PO4