Zadanie z chemii z działu: Chemia fizyczna
W temperaturze pokojowej kwas octowy jest cieczą, która w nieograniczonym stopniu miesza się z etanolem. Kwas salicylowy (C7H6O3) jest krystalicznym ciałem stałym w temperaturze poniżej 159 °C. Jest bardzo dobrze rozpuszczalny w etanolu (stężenie nasyconego roztworu w temp. 50 °C wynosi ok. 45%). Badano równowagę reakcji estryfikacji etanolu w reakcji z kwasem octowym oraz równowagę estryfikacji etanolu w reakcji z kwasem salicylowym. Powstające estry i woda mieszają się z pozostałymi składnikami układu. Przygotowano dwa zestawy reakcyjne. W pierwszym zestawie: w kolbie reakcyjnej umieszczono 20 g kwasu octowego i 80 g etanolu. W drugim zestawie: w kolbie reakcyjnej umieszczono 20 g kwasu salicylowego i 80 g etanolu. Oba zestawy doprowadzono do odpowiedniej temperatury i wprowadzono po 0,5 cm3 st. H2SO4.
Zadanie 1
Uzupełnij tabelę. Wpisz homogeniczny lub heterogeniczny w odpowiednie pola.
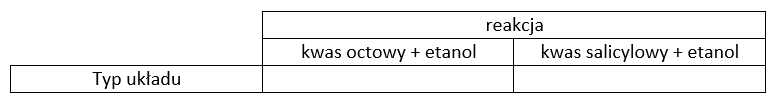
Członkowie studenckiej sekcji laboratoryjnej literami A i B oznaczyli zapisane przez siebie wyrażenia na stałą równowagi estryfikacji kwasu salicylowego z etanolem. Wzór C9H10O3 oznacza ester.
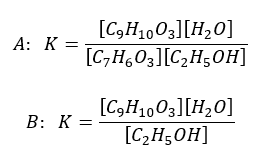
Jako prawidłowo zapisane wyrażenie studenci wybrali B, ponieważ kwas salicylowy jako jedyny reagent jest ciałem stałym w temperaturze prowadzenia procesu.
Zadanie 2
Rozstrzygnij, czy studenci dokonali prawidłowego wyboru. Uzasadnij swój wybór.
Rozstrzygnięcie: ………………………………………
Uzasadnienie: …………………………………………
Zadanie 1
poprawna odpowiedź:
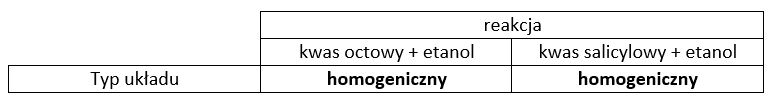
Zadanie 2
poprawna odpowiedź:
Rozstrzygnięcie: Nie
Uzasadnienie: układ reakcyjny jest jednorodny, zatem kwas salicylowy jest rozpuszczony i jego stężenie zmienia się w czasie reakcji.