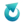Zadania z działu: Chemia fizyczna
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Tlenek wapnia w sposób egzotermiczny reaguje z wodą wg równania:
CaO + H2O → Ca(OH)2
Przeprowadzono dwa doświadczenia, przedstawione na schemacie. Wszystkie składniki oraz otoczenie miały początkową temperaturę 25 °C. Temperatura otoczenia nie zmieniła się podczas doświadczenia.
Zadanie 1
Uzupełnij zdania. Wybierz i podkreśl po jednym określeniu z nawiasu.
Po zamieszaniu zawartości temperatura układu w zlewce I była (wyższa od 25 °C / niższa od 25 °C), co oznacza, że układ (zaczął oddawać ciepło do otoczenia / przyjmować ciepło od otoczenia). Po zakończeniu zmian w zlewce I otrzymano (układ jednorodny / zawiesinę).Zadanie 2
W zlewce II zaobserwowano powstanie zawiesiny.
Wybierz zdanie, które w prawidłowo opisuje wynik doświadczenia w zlewce II.
A. W zlewce II nie doszło do zmiany temperatury, ponieważ tlenek wapnia nie reaguje z zasadą sodową.
B. Otrzymanie zawiesiny świadczy o tym, że tlenek wapnia nie reaguje z zasadą sodową.
C. W zlewce II zaszła reakcja, ale jej substraty i produkty są inne niż w zlewce I, więc efekt cieplny jest inny niż w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
D. Tlenek wapnia przereagował z zasadą sodową, a efekt cieplny jest praktycznie taki sam jak w zlewce I. Powstanie zawiesiny nie świadczy o braku reakcji w zlewce II.
Na razie się wstrzymam ;-)
Ale podam w niedługim czasie.
Zadanie z kwasem mrówkowym i próbą Trommera, jakie mogłoby pojawić się na maturze 😊
Przypominam też, że NIE MUSICIE WIEDZIEĆ, CZY KWAS MRÓWKOWY ULEGA PRÓBIE TROMMERA ALBO TOLLENSA. MACIE TYLKO WIEDZIEĆ, ŻE KWAS TEN MA (WOBEC SILNYCH UTLENIACZY) WŁAŚCIWOŚCI REDUKUJĄCE. Dalsze informacje dla tegorocznych maturzystów znajdują się pod treścią zadania.
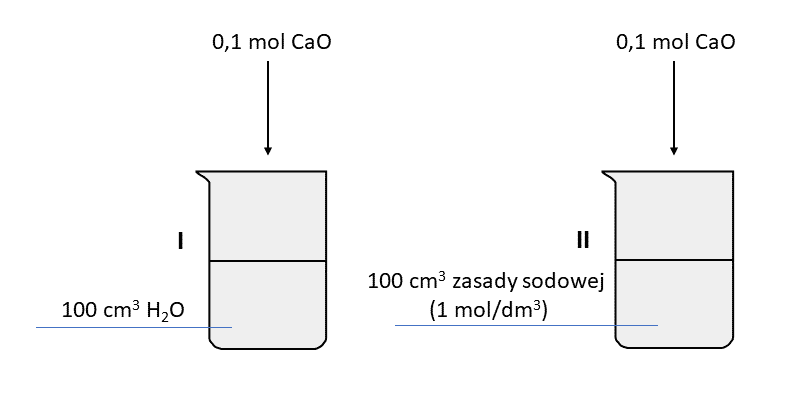
Przeprowadzono serię doświadczeń, w których porównywano zachowanie dwóch reduktorów organicznych: metanalu i kwasu metanowego (mrówkowego) wobec różnych utleniaczy w wodnym środowisku: roztwór wodorotlenku diaminasrebra i zalkalizowana zawiesina wodorotlenku miedzi(II). W doświadczeniach nr 4 i 5 użyto takiej ilości zasady, by dodany kwas metanowy nie spowodował zmiany odczynu mieszaniny reakcyjnej na obojętny lub kwasowy. Wyniki doświadczenia przedstawiono w tabeli. Pewne miejsce pozostawiono jednak puste, a w pozostałych przypadkach podano niektóre z objawów reakcji.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno wyrażenie z podanych w nawiasach.
Można stwierdzić, że metanal ma (silniejsze / słabsze) właściwości redukcyjne, niż kwas metanowy. W zasadowym środowisku, spośród Cu(OH)2(s) i [Ag(NH3)2]+ silniejszym utleniaczem jest ten (pierwszy / drugi). Na podstawie wyniku doświadczenia nr 6 można stwierdzić, że roztwór reakcyjny w doświadczeniu nr 3 (pozostał pomarańczowy / zmienił barwę z pomarańczowej na żółtą / zmienił barwę z pomarańczowej na zieloną). Uwalnianie się bezbarwnego gazu zaobserwowano w doświadczeniu nr 6. Gaz ten (powstawał także / nie powstawał) w doświadczeniu nr 5.
********************************************
W 2015 roku pojawiło się zadanie dotyczące zachowania kwasu mrówkowego w próbie Trommera. Z INFORMACJĄ WSTĘPNĄ, bo jak piszę - nigdy nie było w wymaganiach, by znać zachowanie tego kwasu w próbie Trommera czy Tollensa. Takie zadanie już więcej się nie pojawiło, ponieważ:
w CKE juz od dawna wiedzą, że kwas ten nie ulega próbie Trommera,
dawniej maturę przygotowywano na podstawie informacji z podręczników szkolnych (którymi zresztą żyje większość chemików). Obecnie treści te są bardziej weryfikowane i jest coraz mniej bubli na maturze, a pewnych rzeczy NIE MA JUŻ WCALE NA maturze z chemii. Bo wiadomo, że były błędne, że pewne rzeczy w podręcznikach są błędne. I nie jest ich mało,
informacja do zadania z 2015 była błędna: oparta na podręcznikowych przekłamaniach, ponadto opis był niezgodny z procedurą przeprowadzania próby Trommera - taki jak do dziś serwują podręczniki szkolne,
Jeśli sami porównacie nowsze i starsze arkusze, to sami zauważycie sporą różnicę w opisach próby Trommera i Tollensa w treści zadań.
No dobra, ale to, że zadanie z 2015 roku było bublem i więcej takowego nie będzie. Ale to nie oznacza, że o ten kwas w ogóle nie będą pytać. Że nie będzie jakiegoś redoksa albo czegoś innego z tym kwasem. Rok temu wymyśliłem takie zadanie, które ma pokazać, jakich zadań co do HCOOH możnaby się spodziewać po skorygowaniu wiadomości co do zachowania się HCOOH.
To, że się dowiedzieli o tym, że HCOOH nie ulega próbie Trommera nie spowodowało, że system egzaminowania padł, a w CKE wszyscy poszli z torbami. Nie po raz pierwszy informacja dotycząca czegoś nie pokrywa się z jakimś starszym arkuszem. Dlatego uważam, że ze zbiorów zadań bazujących na kopiuj+wklej z arkuszy CKE należy pewne zadania powywalać, bo dziś wprowadzają w błąd i są źródłem zamieszania. Tak więc to, że raz palnęli: "HCOOH ulega próbie Trommera" nie oznacza, że "na maturze piszemy, że HCOOH ulega próbie Trommera". A co zrobicie, jak serio dostaniecie takie zadanie podobne do tego? Odpowiecie sprzecznie z podaną infomacją do zadania, bo na maturze piszemy że... Czy raczej wywnioskujecie coś z tej informacji?
A jeśli ktoś będzie miał zagwozdkę "dlaczego takie odpowiedzi?" to niech sobie spróbuje zapisać równanie albo chociaż schemat reakcji - z uwzględnieniem środowiska, w którym ta reakcja zachodzi ☺
poprawna odpowiedź:
Można stwierdzić, że metanal ma (silniejsze / słabsze) właściwości redukcyjne, niż kwas metanowy. W zasadowym środowisku, spośród Cu(OH)2(s) i [Ag(NH3)2]+ silniejszym utleniaczem jest ten (pierwszy / drugi). Na podstawie wyniku doświadczenia nr 6 można stwierdzić, że roztwór reakcyjny w doświadczeniu nr 3 (pozostał pomarańczowy / zmienił barwę z pomarańczowej na żółtą / zmienił barwę z pomarańczowej na zieloną). Uwalnianie się bezbarwnego gazu zaobserwowano w doświadczeniu nr 6. Gaz ten (powstawał także / nie powstawał) w doświadczeniu nr 5.
W laboratorium, w którym panowała temperatura 21 °C, przygotowano wodny roztwór NH4NO3 w następujący sposób. Stały NH4NO3 i wodę demineralizowaną (oczyszczoną) ogrzano od temperatury otoczenia do 80 °C. Następnie substancje przeniesiono do umieszczonej na stole laboratoryjnym zlewki i zamieszano. Sól uległa całkowitemu rozpuszczeniu. Stwierdzono, że tuż po rozpuszczeniu soli otrzymany roztwór ma temperaturę 65 °C.
Oceń poprawność poniższych zdań. Zaznacz P, jeśli informacja jest prawdziwa, albo F, jeśli jest fałszywa.
Rozpuszczanie azotanu(V) amonu w wodzie jest procesem endotermicznym P F W czasie wykonanego doświadczenia układ pobrał ciepło od otoczenia P F poprawna odpowiedź:
Rozpuszczanie azotanu(V) amonu w wodzie jest procesem endotermicznym P F W czasie wykonanego doświadczenia układ pobrał ciepło od otoczenia P F Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Celem doświadczenia było odróżnienie dwóch, oznaczonych umownie literami X i Z, metali, z których wykonano płytki. Wiadomo, że jednym metalem był cynk, a drugim – nikiel.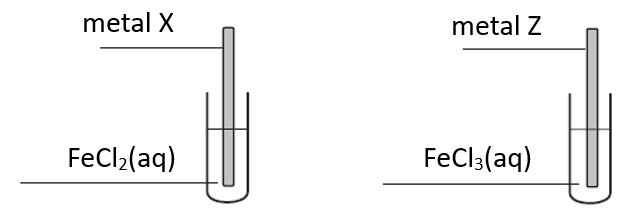
Po pewnym czasie płytki wyjęto z roztworów i osuszono. Zważono płytkę wykonaną z metalu X i stwierdzono, że masa tej płytki uległa zmianie.
Zadanie 1
Uzupełnij poniższe zdania. Wybierz i zaznacz właściwe określenie spośród podanych w każdym nawiasie oraz napisz w formie jonowej skróconej równanie zachodzącej reakcji.
Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła), a podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem:
.................................................................................................
Metalem Z był (cynk / nikiel).
Zadanie 2
Rozstrzygnij, czy do odróżnienia metali od siebie wystarczająca jest informacja, że masa płytki wykonanej z metalu X uległa zmianie. Wybierz po jednym określeniu z każdego nawiasu.
Odróżnienie metali na podstawie tej informacji (jest / nie jest) możliwe, ponieważ w czasie trwania doświadczenia masa płytki wykonanej z metalu Z się (także się zmniejszyła / także się zwiększyła / nie uległa zmianie). W naczyniu, w którym umieszczona była płytka z metalu Z (sól żelaza pozostała niezmieniona / powstała inna sól żelaza / powstało metaliczne żelazo).
poprawna odpowiedź:
Zadanie 1
Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła).
Podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem:
Zn + Fe2+ → Zn2+ + Fe
Metalem Z był (cynk / nikiel).
W tym samym czasie masa płytki wykonanej z metalu Z się (zmniejszyła / zwiększyła / nie uległa zmianie).
Zadanie 2
Odróżnienie metali na podstawie tej informacji (jest / nie jest) możliwe, ponieważ w czasie trwania doświadczenia masa płytki wykonanej z metalu Z się (także się zmniejszyła / także się zwiększyła / nie uległa zmianie). W naczyniu, w którym umieszczona była płytka z metalu Z (sól żelaza pozostała niezmieniona / powstała inna sól żelaza / powstało metaliczne żelazo).Przyjmuje się, że elektrolity dzielimy na słabe (a < 5%), średnie mocy (5% ≤ a <30%) i mocne (a>30%). W dwóch zlewkach (oznaczonych umownie A i B) umieszczono po 100 g czystej wody (pozbawionej CO2 i innych gazów wpływających na jej pH) umieszczono po 1 g odpowiedniej substancji:
A – 1 g Ca(OH)2 (M = 74 g∙mol-1)
B – 1 g kwasu benzoesowego (benzenokarboksylowego, M = 122 g∙mol-1)Zawartość zlewek zamieszano. W obu naczyniach stwierdzono, że nie otrzymano układu jednorodnego. Po opadnięciu ciała stałego na dno pobrano próbki cieczy znad osadu do badań i otrzymano następujące wyniki:
Związek
masa substancji rozpuszczonej w g na 100 cm-3 roztworu
(25 °C)
pH roztworu (25 °C)
Ca(OH)2
0,16
12,65
kwas benzoesowy
0,34
2,88
Zadanie 1
Poniżej podano kilka wartości procentowych. Wybierz i podkreśl tę wartość, która może odpowiadać stopniowi dysocjacji wodorotlenku wapnia.<5% • 17% • 34% • ≈100%
Zadanie 2
Dokończ zdania. Wybierz po jednym określeniu z każdego nawiasu.
Wodorotlenek wapnia oraz kwas benzoesowy są związkami (dobrze rozpuszczalnymi / nieznacznie rozpuszczalnymi) w wodzie. Wodorotlenek wapnia tworzy w wodzie (słaby / mocny) elektrolit gdyż jest (zdysocjowany praktycznie całkowicie / zdysocjowany nieznacznie / rozpuszczalny nieznacznie). Kwas benzoesowy tworzy w wodzie (mocny / słaby elektrolit), ponieważ jest nieznacznie (zdysocjowany / rozpuszczalny).
Zadanie 1
Poprawna odpowiedź:
<5% • 17% • 34% • ≈100%Zadanie 2
Poprawna odpowiedź:
Wodorotlenek wapnia oraz kwas benzoesowy są związkami (dobrze rozpuszczalnymi / nieznacznie rozpuszczalnymi) w wodzie. Wodorotlenek wapnia tworzy w wodzie (słaby / mocny) elektrolit gdyż jest (zdysocjowany praktycznie całkowicie / zdysocjowany nieznacznie / rozpuszczalny nieznacznie). Kwas benzoesowy tworzy w wodzie (mocny / słaby elektrolit), ponieważ jest nieznacznie (zdysocjowany / rozpuszczalny).Cyjanowodór bardzo dobrze rozpuszcza się w wodzie i w niewielkim stopniu ulega dysocjacji
jonowej zgodnie z równaniem:HCN + H2O ⇄ H3O+ + CN-
Wodny roztwór cyjanowodoru nosi nazwę kwasu cyjanowodorowego. W temperaturze 25 °C
stała dysocjacji tego kwasu Ka = 6,2 10-10.
Do probówki zawierającej wodny roztwór wodorowęglanu NaCN wprowadzono – pod wyciągiem, gazowy CO2. Przebieg doświadczenia przedstawiono na rysunku.
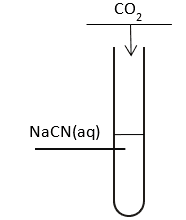
Napisz w postaci cząsteczkowej równanie zachodzącej reakcji zachodzącej podczas wykonywanego doświadczenia.
Poprawna odpowiedź:
CO2 + H2O + NaCN → NaHCO3 + HCN(↑)Ciekły (skroplony) amoniak (NH3(c)) jest rozpuszczalnikiem, który – podobnie jak woda – ulega autodysocjacji
polegającej na przeniesieniu protonu między cząsteczkami rozpuszczalnika, w wyniku czego powstają forma kationowa oraz forma anionowa rozpuszczalnika.
NH3 + NH3 ⇄ NH4++ NH2-
Ciekły amoniak jest rozpuszczalnikiem dla wielu polarnych związków. Te substancje, które rozpuszczone w amoniaku powodują zwiększenie stężenia formy kationowej, są w danym rozpuszczalniku kwasami, a te, które zwiększają stężenie formy anionowej, są w danym rozpuszczalniku zasadami.Zadanie 1
Chlorowodór po rozpuszczeniu w ciekłym amoniaku tworzy mocny elektrolit.
Zapisz równanie dysocjacji chlorowodoru w ciekłym amoniaku. Uwzględnij, że w procesie tym powstaje odpowiednia forma rozpuszczalnika. Napisz, jaki jest odczyn otrzymanego roztworu (kwasowy, obojętny lub zasadowy).Równanie reakcji:…………………………………………….
Odczyn roztworu:………………………………………….Zadanie 2
Azotan(V) amonu rozpuszcza się w ciekłym amoniaku. Roztwór utleniająco na metale, podobnie jak roztwór HNO3 w wodzie. W przypadku miedzi reakcję z roztworem NH4NO3 w amoniaku przedstawia schemat:
Cu + NH4++ NO3- → Cu2+ + NO2- + H2O + NH3
Do amoniakalnego roztworu NH4NO3 w NH3(c) wprowadzono (w nadmiarze) metaliczną miedź. Reakcja zaszła w 100%.
Oceń poprawność poniższych zdań. Zaznacz P, jeśli informacja jest prawdziwa albo F, jeśli jest fałszywa.
W reakcji metalicznej miedzi z roztworem NH4NO3 w NH3(c) powstaje brunatny gaz
P
F
Rozpuszczając w skroplonym amoniaku NH4NO3 można otrzymać roztwór o tych samych właściwościach, co rozpuszczając HNO3 w skroplonym amoniaku.
P
F
W mieszaninie poreakcyjnej obecne są związki azotu(-III), azotu(III) i azotu(V).
P
F
Zadanie 1
Poprawna odpowiedź:
Równanie reakcji: HCl + NH3 ⇄ NH4++ Cl-
Odczyn roztworu: kwasowy
Zadanie 2
Poprawna odpowiedź:
F, P, PDo probówki ze stałym etanianem (octanem) sodu dodano rozcieńczony kwas solny i zawartość naczynia ogrzano. U wylotu próbówki wyczuwalny był charakterystyczny ostry zapach.
Zadanie 1
Napisz, czy użycie do przeprowadzenia opisanego doświadczenia wodnego roztworu kwasu siarkowego(VI) zamiast kwasu solnego pozwoli na zaobserwowanie podobnych efektów................................................................................................................
Zadanie 2
W dwóch nieopisanych probówkach znajdują się wodne roztwory dwóch soli (każdy roztwór w innej probówce). Wiadomo, że jednym roztworem jest wodny roztwór etanianu (octanu) wapnia, a drugim – wodny roztwór etanianu (octanu) sodu.
Rozstrzygnij, czy po dodaniu wodnego roztworu kwasu siarkowego(VI) do obu probówek i ogrzaniu ich zawartości możliwe będzie wskazanie, w której probówce znajdował się wodny roztwór etanianu wapnia, a w której – wodny roztwór etanianu sodu. Odpowiedź uzasadnij.
Rozstrzygnięcie: ...................................................................................................
Uzasadnienie:………………………………………….................................................Zadanie 1
Poprawna odpowiedź:
Tak, ponieważ zarówno kwas solny jak i kwas siarkowy(VI) są mocniejsze od kwasu octowego.Zadanie 2
Poprawna odpowiedź:
Rozstrzygnięcie: Tak
Uzasadnienie: w probówce z etanianem wapnia dodatkowo wytrąci się osad lub tylko w probówce z octanem wapnia wytrąci się osad.Wodorotlenek wapnia jest związkiem trudno rozpuszczalnym w wodzie. W gorącej wodzie jego rozpuszczalność jest nieco niższa niż w zimnej. Związek ten otrzymuje się w egzotermicznej reakcji CaO z wodą. Przeprowadzono doświadczenie, w którym do zlewki z wodą o temperaturze 20 °C wprowadzono stały CaO.
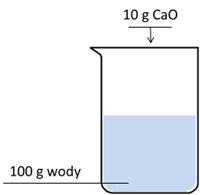
Następnie zamieszano zawartość zlewki.
Zadanie 1.
Nasycony roztwór wodorotlenku wapnia zwiemy wodą wapienną, a wodną zawiesinę tego związku mlekiem wapiennym.
Dokończ zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
W opisanym doświadczeniu otrzymano (wodę wapienną / mleko wapienne). Mleko wapienne można otrzymać wprowadzając do wody wapiennej (tlenek wapnia / wodorotlenek wapnia / tlenek lub wodorotlenek wapnia). Wodę wapienną można otrzymać z mleka wapiennego przez wprowadzenie do niego (wody destylowanej / tlenku wapnia ).
Zadanie 2.
Po dodaniu CaO i zamieszaniu zawartości zlewki nie stwierdzono zaniku, ani zmiany barwy ciała stałego.
Wyjaśnij, dlaczego na podstawie powyższej obserwacji nie można zgodzić się ze stwierdzeniem:
Brak widocznych objawów reakcji jest równoznaczny z brakiem reakcji chemicznej.
Odnieś się do stanu układu przed i po zamieszaniu zawartości zlewki.
………………………………………………………………………………………
Zadanie 3.
Z podanych poniżej czynności wybierz te, które należy wykonać, aby potwierdzić, że w opisanym doświadczeniu otrzymano Ca(OH)2. Podkreśl wszystkie prawidłowe czynności.• Wprowadzenie kwasu solnego • Wprowadzenie kropli alkoholowego roztworu fenoloftaleiny • Wprowadzenie zwilżonego uniwersalnego papierka wskaźnikowego u wylotu zlewki • Porównanie temperatury ścianek zlewki przed i po zakończeniu doświadczenia • Dodatek zasady sodowej
Zadanie 4.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.1.
W tej samej temperaturze mleko wapienne ma wyższe pH niż woda wapienna ze względu na wyższy udział Ca(OH)2.
P
F
2.
Ogrzewając wodę wapienną bez dostępu powietrza zaobserwujemy wytrącenie nieznacznej ilości osadu Ca(OH)2.
P
F
3.
Woda wapienna służy do wykrywania CO2 w powietrzu lub innych gazach. Zamiast niej można użyć mleka wapiennego.
P
F
Poprawna odpowiedź:
Zadanie 1.
W opisanym doświadczeniu otrzymano (wodę wapienną / mleko wapienne). Mleko wapienne można otrzymać wprowadzając do wody wapiennej (tlenek wapnia / wodorotlenek wapnia / tlenek lub wodorotlenek wapnia). Wodę wapienną można otrzymać z mleka wapiennego przez wprowadzenie do niego (wody demineralizowanej / tlenku wapnia ).Zadanie 2.
W trakcie doświadczenia zaszła reakcja chemiczna, ale powstający wodorotlenek wapnia jest trudno rozpuszczalny, przez co nie obserwujemy roztworzenia ciała stałego podczas reakcji CaO z wodą.
Zadanie 3.
• Wprowadzenie kwasu solnego • Wprowadzenie kropli alkoholowego roztworu fenoloftaleiny • Wprowadzenie zwilżonego uniwersalnego papierka wskaźnikowego u wylotu zlewki • Porównanie temperatury ścianek zlewki przed i po zakończeniu doświadczenia • Dodatek zasady sodowejZadanie 4.
1.
W tej samej temperaturze mleko wapienne ma wyższe pH niż woda wapienna ze względu na wyższy udział Ca(OH)2.
F
2.
Ogrzewając wodę wapienną bez dostępu powietrza zaobserwujemy wytrącenie nieznacznej ilości osadu Ca(OH)2.
P
3.
Woda wapienna służy do wykrywania CO2 w powietrzu lub innych gazach. Zamiast niej można użyć mleka wapiennego.
F
Kwas fosforowy(V) (H3PO4) jest słabym kwasem trójprotonowowym, a zdolność do odszczepienia kolejnych kationów wodoru jest silnie zróżnicowana. Z wodorotlenkami litowców można otrzymać 3 typy soli: diwodoroortofosforany(V), wodoroortofosforany(V) i ortofosforany(V). Wodne roztwory diwodorofosforanu(V) sodu mają odczyn lekko kwasowy. Z kolei roztwory wodorofosforanu disodu mają odczyn lekko zasadowy, co można potwierdzić za pomocą wskaźnika I. Trzecią solą jest fosforan trisodu, którego wodne roztwory mają silnie zasadowy odczyn.
Poniżej przedstawiono barwy, jakie przyjmują dwa wskaźniki kwasowo-zasadowe w zależności od pH i zakres zmiany barwy.
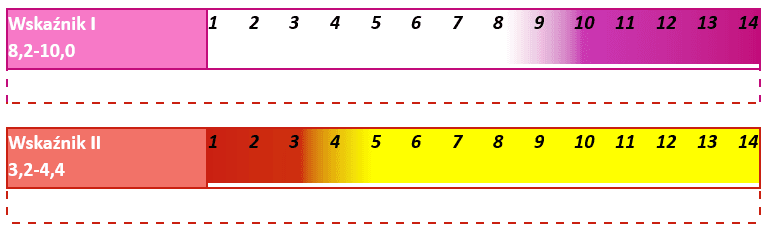
Zadanie 1
Oceń prawdziwość zdań. Zaznacz P, jeśli informacja jest prawdziwa, alfo F, jeśli jest fałszywa.Wskaźnikiem I jest wskaźnik uniwersalny. P F Wobec wskaźnika I można oznaczać kwas fosforowy w reakcji z mianowanym roztworem NaOH, której sumaryczne równanie można zapisać jako: 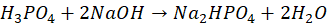
P F Podczas miareczkowania wodnym roztworem NaOH wodnego roztworu H3PO4 z dodatkiem wskaźnika II, zmiana barwy wskaźnika z czerwonej na żółtopomarańczową oznacza, że został osiągnięty stosunek molowy kwasu do zasady 1 : 1. P F Zadanie 2
Rozstrzygnij, czy możliwe jest oznaczenie stężenia roztworu kwasu fosforowego(V) poprzez miareczkowanie mianowanym roztworem wodorotlenku potasu, gdy punkt końcowy miareczkowania odpowiada otrzymaniu roztworu K3PO4. Przyjmij, że miareczkowanie prowadzone jest wobec wskaźnika I.Rozstrzygnięcie:………………………..
Zadanie 3
Z roztworu H3PO4 pobrano pipetą 100 cm3 przeniesiono do kolby stożkowej. Następnie dodano 2 krople alkoholowego roztworu wskaźnika I i miareczkowano roztworem wodorotlenku potasu momentu, aż zawartość kolby przyjęła trwałe różowe zabarwienie. Wkroplono 40 cm3 roztworu wodorotlenku potasu. Do drugiej kolby stożkowej wprowadzono za pomocą pipety 100 cm3 tego samego roztworu H3PO4, dodano 2 krople alkoholowego roztworu wskaźnika II i miareczkowano tym samym roztworem wodorotlenku potasu do zmiany barwy wskaźnika z czerwonej na żółtopomarańczową.
Napisz, jaką objętość roztworu KOH wprowadzono do kolby w chwili, gdy nastąpiła opisana zmiana barwy wskaźnika.
…………………………………………………………………………………………………
Zadanie 4
Ze względu na daleko posuniętą hydrolizę wodne roztwory Na3PO4 mają odczyn silnie zasadowy. Z kolei fosforan wapnia Ca3(PO4)2 jest związkiem bardzo trudno rozpuszczalnym w wodzie. Stężenie jonów wapnia i jonów fosforanowych w roztworze nad osadem tej soli jest znikome, a więc odczyn nasyconego roztworu Ca3(PO4)2 (tj. cieczy nad osadem Ca3(PO4)2) jest bliski obojętnego. Kwas fosforowy można oznaczyć inaczej, osiągając stosunek molowy kwasu do zasady 1 : 3. W tym celu, jeszcze przed rozpoczęciem miareczkowania, do badanego roztworu dodaje się roztworu chlorku wapnia w takiej ilości, by stanowiła on nadmiar w stosunku do kwasu fosforowego obecnego w roztworze. Następnie rozpoczyna się wkraplanie zasady. W miarę dodawania zasady w roztworze rośnie stężenie anionów kwasu fosforowego o coraz większym ładunku ujemnym.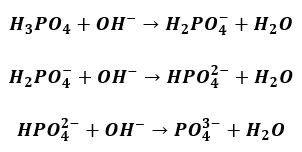
Już niewielkie stężenie jonów fosforanowych powoduje, że reagują one z obecnymi w roztworze jonami wapnia wg równania:
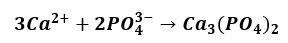
W ten sposób aniony fosforanowe są na bieżąco usuwane z roztworu, co zapobiega zbytniemu podnoszeniu pH mieszaniny reakcyjnej wskutek hydrolizy powstających fosforanów. Strącenie osadu zachodzi do momentu, w którym w układzie zabraknie niezobojętnionego kwasu. Miareczkowanie prowadzi się w obecności wskaźnika I do pojawienia się trwałego różowego zabarwienia, co oznacza punkt końcowy.
Napisz w postaci cząsteczkowej sumaryczne równanie reakcji, która zachodzi podczas wkraplania roztworu KOH do roztworu H3PO4 z dodatkiem CaCl2 do chwili pojawienia się trwałego różowego zabarwienia zawartości kolby.
…………………………………………………………………………………………………….
Zadanie 5
Podczas miareczkowania próbki kwasów fosforowego w obecności jonów wapnia i wskaźnika I zużyto 60 cm³ roztworu wodorotlenku potasu.
Napisz jaką objętość roztworu wodorotlenku potasu zużyto podczas miareczkowania tej próbki bez dodatku jonów wapnia do osiągnięcia trwałego różowego zabarwienia.
………………………………………………………………………………………………………Zadanie 6
Podczas dodawania roztworu Ca(NO3)2 do zlewki zawierającej wodny roztwór K3PO4 zachodzi reakcja opisana równaniem:
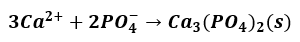
Dokończ zdania. Wybierz i pokreśl po jednym określeniu z każdego nawiasu.
W czasie reakcji pomiędzy fosforanem(V) potasu a azotanem(V) wapnia pH fazy wodnej (ulega obniżeniu / ulega podniesieniu / nie zmienia się). W tej sytuacji wskaźnikiem całkowitego przereagowania K3PO4 (może / nie może) być wskaźnik I.
Zadanie 1
Poprawna odpowiedź:Wskaźnikiem I jest wskaźnik uniwersalny. P F Wobec wskaźnika I można oznaczać kwas fosforowy w reakcji z mianowanym roztworem NaOH, której sumaryczne równanie można zapisać jako: 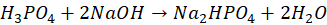
P F Podczas miareczkowania wodnym roztworem NaOH wodnego roztworu H3PO4 z dodatkiem wskaźnika II, zmiana barwy wskaźnika z czerwonej na żółtopomarańczową oznacza, że został osiągnięty stosunek molowy kwasu do zasady 1 : 1. P F Zadanie 2
poprawna odpowiedź:
Rozstrzygnięcie: NIEZadanie 3
poprawna odpowiedź:
20 cm3Zadanie 4
poprawna odpowiedź:
2H3PO4 + 6KOH + 3CaCl2 → Ca3(PO4)2(s) + 6KCl + 6H2O
Uwaga: symbol (s) albo ↓ przy wzorze Ca3(PO4)2 nie jest obowiązkowy.Zadanie 5
poprawna odpowiedź:
40 cm3Zadanie 6
W czasie reakcji pomiędzy fosforanem(V) potasu a azotanem(V) wapnia pH fazy wodnej (ulega obniżeniu / ulega podniesieniu / nie zmienia się). W tej sytuacji wskaźnikiem całkowitego przereagowania K3PO4 (może / nie może) być wskaźnik I.