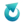Zadania z działu: Chemia nieorganiczna (pierwiastki bloków s, p, d)
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Zadanie konkursowe
Laboratoryjna metoda otrzymywania wody amoniakalnej polega na wyparciu amoniaku z soli amonowych, a następnie, wykorzystując jego dobre i szybkie rozpuszczanie się w wodzie – na skierowaniu strumienia gazu nad wodę. Przygotowano wodny roztwór NH4NO3, zawiesinę Ca(OH)2 (mleko wapienne) i wodę destylowaną. Następnie zestawiono aparaturę jak na obrazku. Wydzielający się w reakcji amoniak rozpuszczano w wodzie destylowanej.
Zadanie 1
Dokończ zdanie. Wpisz wzory lub nazwy substancji w puste miejsca.
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić ..................................... i ...................................., a w kolbie stożkowej należy umieścić ........................................................ .
Zadanie 2
Napisz w postaci cząsteczkowej równanie reakcji zachodzącej podczas otrzymywania gazowego amoniaku opisaną metodą.Zadanie 3
Wyjaśnij, dlaczego poziom cieczy w kolbie stożkowej powinien być tak dobrany, aby rurka wylotowa nie była w niej zanurzona.Zadanie 4
Napisz, jakie dwa objawy możliwe do zaobserwowania świadczą o tym, że w kolbie kulistej ma miejsce reakcja chemiczna.Zadanie 1
Poprawna odpowiedź:
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić NH4NO3 i Ca(OH)2, a w kolbie stożkowej należy umieścić wodę destylowaną.Zadanie 2
Poprawna odpowiedź: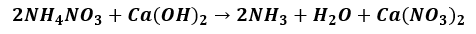
Zadanie 3
Poprawna odpowiedź:
Amoniak bardzo szybko rozpuszcza się w wodzie. Jeśli amoniak będzie się rozpuszczał szybciej niż wydzielał w reakcji, to grozi to obniżeniem ciśnienia w kolbie poniżej ciśnienia otoczenia i zassania wody do kolby kulistej.Zadanie 4
Poprawna odpowiedź:
1. wydzielanie (bezbarwnego) gazu (o ostrym zaoachu)
2. roztwarzanie ciała stała stałego/zanik ciała stałego/ujednorodnienie układu
Zadanie 2
Kwas ortofosforowy(V) o wzorze H3PO4 jest ostatecznym i trwałym produktem uwodnienia dekatlenku tetrafosforu. Znanych jest jednak wiele kwasów fosforowych i ich soli. Kwasy takie są produktami częściowego uwodnienia dekatlenku tetrafosforu. Kwas difosforowy(V), zwany także pirofosforowym(V) ma wzór H4P2O7.Związek ten rozpuszczony w wodzie jest kwasem Broensteda, a ujemne logarytmy poszczególnych stałych równowagi dysocjacji (w 25 °C) mają następujące wartości: pKa1 = 0,91, pKa2 = 2,10, pKa3 = 6,70, pKa4 = 9,32.
Zadanie 2.1
Oceń poprawność zdań. Zaznacz P, jeśli informacja jest prawdziwa, albo F, jeśli jest fałszywa.H4P2O7 jest kwasem słabszym od H3PO4
P
F
H4P2O7 jest kwasem czteroprotonowym
P
F
Zadanie 2.2
Difosforany(V) można otrzymać w wyniku ogrzewania wodorofosforanów(V), np.: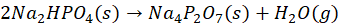
Difosforan(V) sodu jak i kwas disfosforowy są dobrze rozpuszczalne w wodzie. Cechą charakterystyczną takich roztworów jest ich nietrwałość. W roztworach tych dochodzi do powolnej reakcji z wodą, o czym świadczą zmiany pH tych roztworów (pomiary wykonywane w tej samej temperaturze).
a) Napisz w postaci cząsteczkowej równanie reakcji kwasu difosforowego(V) z wodą.
b) Napisz w postaci jonowej równanie reakcji anionów difosforanowych(V) z wodą.
Zadanie 2.1
poprawna odpowiedź:H4P2O7 jest kwasem słabszym od H3PO4
P
F
H4P2O7 jest kwasem czteroprotonowym
P
F
Zadanie 2.2
a) poprawna odpowiedź: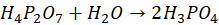
b) poprawna odpowiedź:
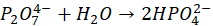
Zadanie 1
Przygotowano zestaw 2 probówek, w których (w nieznanej kolejności) umieszczono roztwór wodorosiarczanu(IV) sodu w wodzie oraz roztwór siarczanu(IV) sodu w wodzie.Do obu probówek wprowadzoną po kilka kropel roztworu KMnO4. Zanotowano następujące zmiany:
I – powstanie brunatnej zawiesiny, po opadnięciu osadu ciecz nad nim jest bezbarwna
II – powstanie bezbarwnego roztworu
Napisz wzory soli, które znajdowały się w poszczególnych probówkach.
Probówka I:…………………………………………………..
Probówka II:………………………………………………….
Zadanie 1
Poprawna odpowiedź:Probówka I: Na2SO3
Probówka II: NaHSO3