Zadanie z chemii z działu: Chemia nieorganiczna (pierwiastki bloków s, p, d)
Zadanie konkursowe
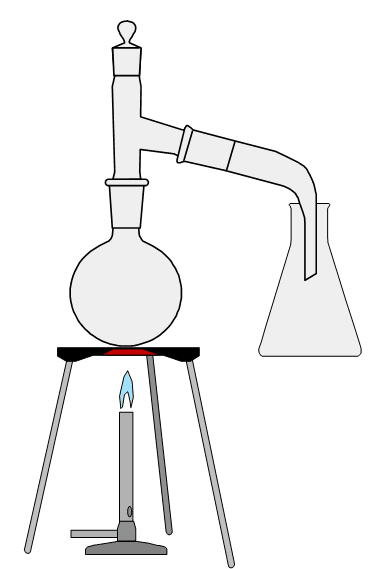
Laboratoryjna metoda otrzymywania wody amoniakalnej polega na wyparciu amoniaku z soli amonowych, a następnie, wykorzystując jego dobre i szybkie rozpuszczanie się w wodzie – na skierowaniu strumienia gazu nad wodę. Przygotowano wodny roztwór NH4NO3, zawiesinę Ca(OH)2 (mleko wapienne) i wodę destylowaną. Następnie zestawiono aparaturę jak na obrazku. Wydzielający się w reakcji amoniak rozpuszczano w wodzie destylowanej.
Zadanie 1
Dokończ zdanie. Wpisz wzory lub nazwy substancji w puste miejsca.
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić ..................................... i ...................................., a w kolbie stożkowej należy umieścić ........................................................ .
Zadanie 2
Napisz w postaci cząsteczkowej równanie reakcji zachodzącej podczas otrzymywania gazowego amoniaku opisaną metodą.
Zadanie 3
Wyjaśnij, dlaczego poziom cieczy w kolbie stożkowej powinien być tak dobrany, aby rurka wylotowa nie była w niej zanurzona.
Zadanie 4
Napisz, jakie dwa objawy możliwe do zaobserwowania świadczą o tym, że w kolbie kulistej ma miejsce reakcja chemiczna.
Zadanie 1
Poprawna odpowiedź:
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić NH4NO3 i Ca(OH)2, a w kolbie stożkowej należy umieścić wodę destylowaną.
Zadanie 2
Poprawna odpowiedź: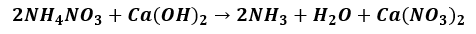
Zadanie 3
Poprawna odpowiedź:
Amoniak bardzo szybko rozpuszcza się w wodzie. Jeśli amoniak będzie się rozpuszczał szybciej niż wydzielał w reakcji, to grozi to obniżeniem ciśnienia w kolbie poniżej ciśnienia otoczenia i zassania wody do kolby kulistej.
Zadanie 4
Poprawna odpowiedź:
1. wydzielanie (bezbarwnego) gazu (o ostrym zaoachu)
2. roztwarzanie ciała stała stałego/zanik ciała stałego/ujednorodnienie układu