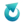Zadania z działu: Doświadczenia chemiczne
Wszystkie umieszczone tutaj zadania są autorskie i nie mogą być udostępniane w innych opracowaniach/materiałach, umieszczane na innych witrynach internetowych bez wcześniejszej wiedzy i zgody autora.Do probówki ze stałym etanianem (octanem) sodu dodano rozcieńczony kwas solny i zawartość naczynia ogrzano. U wylotu próbówki wyczuwalny był charakterystyczny ostry zapach.
Zadanie 1
Napisz, czy użycie do przeprowadzenia opisanego doświadczenia wodnego roztworu kwasu siarkowego(VI) zamiast kwasu solnego pozwoli na zaobserwowanie podobnych efektów................................................................................................................
Zadanie 2
W dwóch nieopisanych probówkach znajdują się wodne roztwory dwóch soli (każdy roztwór w innej probówce). Wiadomo, że jednym roztworem jest wodny roztwór etanianu (octanu) wapnia, a drugim – wodny roztwór etanianu (octanu) sodu.
Rozstrzygnij, czy po dodaniu wodnego roztworu kwasu siarkowego(VI) do obu probówek i ogrzaniu ich zawartości możliwe będzie wskazanie, w której probówce znajdował się wodny roztwór etanianu wapnia, a w której – wodny roztwór etanianu sodu. Odpowiedź uzasadnij.
Rozstrzygnięcie: ...................................................................................................
Uzasadnienie:………………………………………….................................................Zadanie 1
Poprawna odpowiedź:
Tak, ponieważ zarówno kwas solny jak i kwas siarkowy(VI) są mocniejsze od kwasu octowego.Zadanie 2
Poprawna odpowiedź:
Rozstrzygnięcie: Tak
Uzasadnienie: w probówce z etanianem wapnia dodatkowo wytrąci się osad lub tylko w probówce z octanem wapnia wytrąci się osad.Polialkohol winylowy i polietylenoimina są polimerami, których wzory przedstawiono poniżej.
Cechą charakterystyczną obu polimerów jest dobra rozpuszczalność w wodzie. W probówkach oznaczonych numerami I i II znajdują się (w losowej kolejności) roztwory wodne obu polimerów. Roztwór każdego polimeru w osobnej probówce.
Zadanie 1
Zaprojektuj doświadczenie, które pozwoli odróżnić od siebie zawartość probówek. Wpisz nazwę jednego odczynnika wybranego z listy, który wprowadzony do obu probówek pozwoli zidentyfikować roztwory i napisz jaka obserwacja pozwoli odróżnić od siebie roztwory.
a) woda siarkowodorowa, b) alkoholowy roztwór fenoloftaleiny, c) wodny roztwór NaOH, d) woda wapienna
Obserwacja:…………………………………………….
Zadanie 2
Napisz równanie równowagi ustalającej się w wodnym roztworze polimeru, która umożliwia odróżnienie roztworu tego polimeru od roztworu drugiego polimeru wybranym odczynnikiem. W równaniu reakcji użyj fragmentu wzoru łańcucha polimerowego odpowiadający jednemu merowi.
Równanie reakcji:……………………………
Poprawna odpowiedź:
Zadanie 1
a) woda siarkowodorowa, b) alkoholowy roztwór fenoloftaleiny, c) wodny roztwór NaOH, d) woda wapienna
Obserwacja: W probówce, w której obecny jest roztwór polietylenoiminy roztwór przyjmuje różowe/malinowe zabarwienie. W drugiej probówce zawartość pozostaje bezbarwna.Zadanie 2
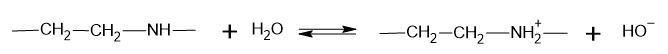
Na2SO3 jest solą słabego kwasu z mocną zasadą. W wodnych roztworach dochodzi do hydrolizy anionowej. W probówce przygotowano roztwór Na2SO3 przez zadanie 1 g Na2SO3 wodą destylowaną w ilości 5 cm3 i wstrząśniecie do całkowitego rozpuszczenia się związku.
Z podanego zestawu wybierz i zaznacz wszystkie obserwowane doświadczalnie zjawiska świadczące o równowadze ustalającej się w roztworze tej soli.
a) z roztworu uwalnia się gaz o drażniącym i duszącym zapachu,
b) po dodaniu kropli alkoholowego roztworu fenoloftaleiny do zawartość probówki przyjmuje różowe zabarwienie
c) w probówce wytrąca się galaretowaty biały osad
d) uniwersalny papierek wskaźnikowy umieszczony w roztworze przyjmuje czerwone zabarwienie
Poprawna odpowiedź:
a) z roztworu uwalnia się gaz o drażniącym i duszącym zapachu,
b) po dodaniu kropli alkoholowego roztworu fenoloftaleiny do zawartość probówki przyjmuje różowe zabarwienie
c) w probówce wytrąca się galaretowaty biały osad
d) uniwersalny papierek wskaźnikowy umieszczony w roztworze przyjmuje czerwone zabarwienieZadanie konkursowe
Wodorotlenek wapnia należy do związków o nieznacznej rozpuszczalności w wodzie, a można go otrzymać w reakcji różnych substancji chemicznych z wodą. Do 4 zlewek wprowadzono po 50 cm3 wody dejonizowanej. Następnie wykonano doświadczenie wg schematu:
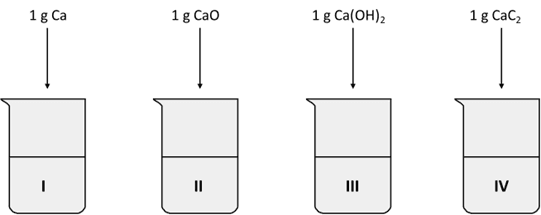
Następnie zawartość zlewek doprowadzono do temperatury 25 °C i porównano pH cieczy. Końcowa objętość fazy ciekłej była identyczna we wszystkich zlewkach.
Zadanie 1
Uszereguj zlewki w kolejności od najmniejszej do największej masy Ca(OH)2 po zakończeniu zmian.Zadanie 2
Uszereguj zlewki w kolejności od najmniejszej do największej wartości pH lub jeśli zwartość zlewek nie różni się pH, to uzasadnij przyczynę tego.We wszystkich zlewkach osiągnięto identyczne pH. Wodorotlenek wapnia w 25 °C rozpuszcza się w ilości ok. 0,16 g/100 g wody. Oznacza to, że w każdej zlewce postał roztwór nasycony i pewna ilość osadu Ca(OH)2 na dnie. We wszystkich zlewkach pH jest więc identyczne.
Zadanie 2
poprawna odpowiedź:III, IV, II, I
Zadanie 2
poprawna odpowiedź:
We wszystkich zlewkach osiągnięto identyczne pH. Wodorotlenek wapnia w 25 °C rozpuszcza się w ilości ok. 0,16 g/100 g wody. Oznacza to, że w każdej zlewce postał roztwór nasycony i pewna ilość osadu Ca(OH)2 na dnie. We wszystkich zlewkach pH jest więc identyczne.Zadanie konkursowe
Laboratoryjna metoda otrzymywania wody amoniakalnej polega na wyparciu amoniaku z soli amonowych, a następnie, wykorzystując jego dobre i szybkie rozpuszczanie się w wodzie – na skierowaniu strumienia gazu nad wodę. Przygotowano wodny roztwór NH4NO3, zawiesinę Ca(OH)2 (mleko wapienne) i wodę destylowaną. Następnie zestawiono aparaturę jak na obrazku. Wydzielający się w reakcji amoniak rozpuszczano w wodzie destylowanej.
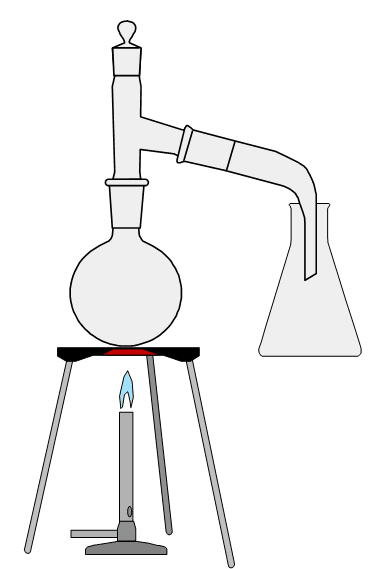
Zadanie 1
Dokończ zdanie. Wpisz wzory lub nazwy substancji w puste miejsca.
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić ..................................... i ...................................., a w kolbie stożkowej należy umieścić ........................................................ .
Zadanie 2
Napisz w postaci cząsteczkowej równanie reakcji zachodzącej podczas otrzymywania gazowego amoniaku opisaną metodą.Zadanie 3
Wyjaśnij, dlaczego poziom cieczy w kolbie stożkowej powinien być tak dobrany, aby rurka wylotowa nie była w niej zanurzona.Zadanie 4
Napisz, jakie dwa objawy możliwe do zaobserwowania świadczą o tym, że w kolbie kulistej ma miejsce reakcja chemiczna.Zadanie 1
Poprawna odpowiedź:
Aby otrzymać wodę amoniakalną w kolbie kulistej należy umieścić NH4NO3 i Ca(OH)2, a w kolbie stożkowej należy umieścić wodę destylowaną.Zadanie 2
Poprawna odpowiedź: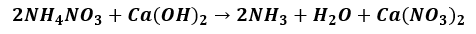
Zadanie 3
Poprawna odpowiedź:
Amoniak bardzo szybko rozpuszcza się w wodzie. Jeśli amoniak będzie się rozpuszczał szybciej niż wydzielał w reakcji, to grozi to obniżeniem ciśnienia w kolbie poniżej ciśnienia otoczenia i zassania wody do kolby kulistej.Zadanie 4
Poprawna odpowiedź:
1. wydzielanie (bezbarwnego) gazu (o ostrym zaoachu)
2. roztwarzanie ciała stała stałego/zanik ciała stałego/ujednorodnienie układu
Zadanie 1
Przygotowano zestaw 2 probówek, w których (w nieznanej kolejności) umieszczono roztwór wodorosiarczanu(IV) sodu w wodzie oraz roztwór siarczanu(IV) sodu w wodzie.Do obu probówek wprowadzoną po kilka kropel roztworu KMnO4. Zanotowano następujące zmiany:
I – powstanie brunatnej zawiesiny, po opadnięciu osadu ciecz nad nim jest bezbarwna
II – powstanie bezbarwnego roztworu
Napisz wzory soli, które znajdowały się w poszczególnych probówkach.
Probówka I:…………………………………………………..
Probówka II:………………………………………………….
Zadanie 1
Poprawna odpowiedź:Probówka I: Na2SO3
Probówka II: NaHSO3