Artykuł ten ukazał się pierwotnie w numerze 7 czasopisma "Antocyjan":

I jest uzupełnieniem do artykułu: „Węglan kwaśny, ale o odczynie zasadowym – rzecz o wodorosolach i hydroksysolach, cz. I. Wodorosole”.
Często pojawiającym się problemem jest pytanie: jaki odczyn mają wodorosole? Spróbujemy sobie na to pytanie poszukać odpowiedzi.
Przypadek pierwszy: sole mocnych zasad
Zacznijmy na początek od prostego przypadku KHSO4 – wodorosiarczanu(VI) potasu. Tutaj sytuacja jest prosta. Rozpuszczając tę sól w wodzie otrzymamy roztwór zawierający jony:
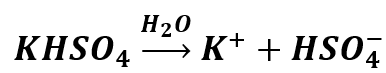
Co jednak dzieje się z jonem HSO4- w roztworze wodnym? Czy ulega on hydrolizie, dalszej dysocjacji, a może obu procesom naraz? Pamiętamy, że kwas siarkowy jest kwasem mocnym, ale tylko na pierwszym stopniu dysocjacji. Oznacza to, że w rozcieńczonych roztworach wodnych można przyjąć jego całkowitą dysocjację na pierwszym stopniu:
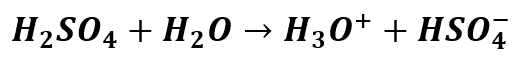
Z kolei na drugim stopniu dysocjacji kwas ten jest już średniej mocy:
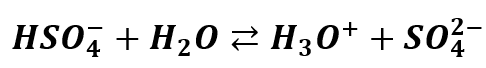
Czyli reakcja zachodzi tylko częściowo – do momentu ustalenia się równowagi. Jest to reakcja odwracalna, stąd strzałki w obie strony, gdyż reakcje równowagowe są odwracalne. Kwas siarkowy posiada stałą dysocjacji dla drugiego stopnia: Ka2=0,01. Właściwie jest to stała dysocjacji jonu HSO4-. Pierwszą reakcję dysocjacji możemy potraktować jako praktycznie nieodwracalną, ale drugiej już nie. A zatem w roztworze wodnym jon HSO4- może ulec częściowej dysocjacji kwasowej:
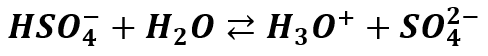
Ale nie ulega hydrolizie (dysocjacji zasadowej):
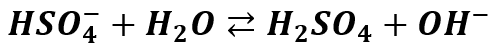
Zatem wróćmy do naszego KHSO4. Rozpuszczając tę sól w wodzie wprowadzamy do roztworu jony wodorosiarczanowe HSO4-, które:
- mogą dysocjować z odszczepieniem protonu
- nie mogą same być protonowane (ulegać hydrolizie anionowej, czyli dysocjacji zasadowej)
Zatem wraz z rozpuszczeniem KHSO4 w wodzie pojawiają się dodatkowe protony, które decydują o odczynie kwasowym. Na razie proste, prawda?
Niestety, żeby zawsze było tak łatwo, to by było zbyt piękne. Sytuacja się skomplikuje, gdy pod uwagę weźmiemy słabe kwasy wieloprotonowe. Regularnie na grupach dyskusyjnych pojawiają się pytania o odczyn wodnych roztworów KH2PO4, K2HPO4, NaH2PO4 czy Na2HPO4. W przypadku K3PO4 czy Na3PO4 wątpliwości nie mamy – odczyn zasadowy ze względu na hydrolizę. Ale co w przypadku wodorosoli, czyli soli nie całkiem zobojętnionego kwasu? Przypomnijmy jeszcze – że kwasu słabego. Spójrzmy jak wygląda stopniowa dysocjacja kwasu ortofosforowego:
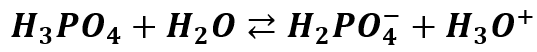
Zwróćmy uwagę na strzałki równowagi – kwas dysocjuje tylko w pewnym stopniu i jest to proces odwracalny. Jednakże powstały jon H2PO4- dysocjuje dalej:
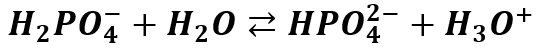
A jon HPO42- także może dalej dysocjować:
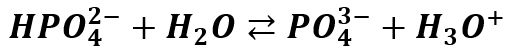
Jednakże każdy stopień dysocjacji jest coraz niższy, bo kwasowość danej cząstki jest niższa, niż kwasowość cząstki poprzedniej. A to oznacza, że stałe dysocjacji są coraz niższe, bo kwas fosforowy najsilniejszym kwasem jest na pierwszym stopniu dysocjacji, a najsłabszym na trzecim.
Rozpuszczając w wodzie KH2PO4 wprowadzamy do niej jony HPO42-:
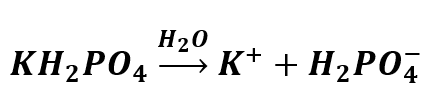
Co dzieje się z anionem w roztworze wodnym?
Z jednej strony chce on dysocjować dalej:
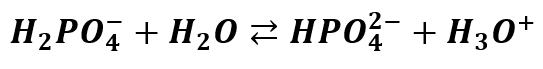
Ale z drugiej strony pamiętamy, że jest on produktem odwracalnej dysocjacji H3PO4. Tak więc jon ten może ulegać protonowaniu i odtwarzać kwas:
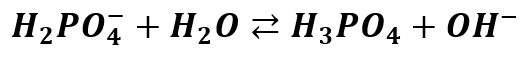
Zatem mamy dwa przeciwne kierunki zachowania się jednego jonu w roztworze wodnym, z czego w jednym powstaje cząstka kwasowa H3O+, a w drugiej zasadowa OH-. A przecież te cząsteczki się wzajemnie zobojętnią i odtworzą wodę. Co więc nam pozostaje? Usiąść i płakać? Na szczęście nie!
Jeśli sprawdzić papierkiem wskaźnikowym, to się okaże, że nasz roztwór ma odczyn lekko kwasowy, pomiędzy 5 a 6. Jak to wyjaśnić? Weźmy pod uwagę, że przecież kwas ortofosforowy chętniej odszczepia proton, niż powstały jon H2PO4- pozbywa się jednego ze swoich protonów. Zatem jeśli jon H2PO4- może zarówno oddawać proton, jak i go przyjmować odtwarzając wolny kwas fosforowy, to wynika z tego, że o odczynie decyduje to, która z tych reakcji zachodzi łatwiej (w większym stopniu). Jeśli będzie dominować dysocjacja kwasowa tych jonów – w roztworze pojawi się nadmiar protonów i odczyn będzie kwasowy. A jeśli zacznie dominować ich protonowanie przez cząsteczki wody – to pojawi się nadmiar jonów OH- i odczyn będzie zasadowy. Wiemy już, że odczyn roztworu tej soli jest lekko kwasowy, zatem dominuje dysocjacja kwasowa nad hydrolizą. Ale sprawdzając odczyn roztworu K2HPO4 czeka nas niespodzianka, bo ma on odczyn lekko zasadowy! Tak więc roztwór KH2PO4 ma odczyn lekko kwasowy, ale już K2HPO4 – lekko zasadowy. Zaraz nauczymy się przewidywania odczynu roztworu wodorosoli.
Przypomnijmy sobie teorię Broensteda-Lovry’ego:
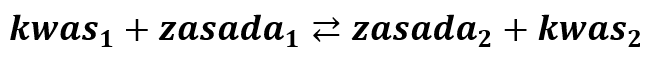
Co uwzględniając przeniesienie protonu możemy zapisać inaczej jako:
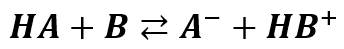
Kwas oddaje swój proton zasadzie, a powstały anion reszty kwasowej jest zasadą i jest protonobiorcą w reakcji przeciwnej. Zatem dla reakcji dysocjacji kwasu zapisujemy stałą równowagi Ka. Zaś dla reakcji przeciwnej, w której bierze udział reszta kwasowa: Kb (ang. acid – kwas, base – zasada). Dla wygody lepiej jest przejść na skalę logarytmiczną. Trzeba jednak pamiętać, że im mniejsza stała równowagi, tym większy jest ujemny logarytm z niej, podobnie jak w przypadku pH. W roztworach wodnych musimy brać pod uwagę, że:
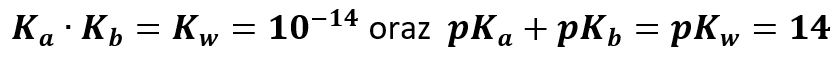
Wartości dotyczą temperatury 25 °C. Stąd też jeśli znamy stałą dysocjacji kwasu lub pKa, to łatwo policzymy stałą równowagi protonowania reszty kwasowej (Kb) lub jej ujemny logarytm (pKb). Rozpatrzmy to naszym przykładzie KH2PO4 – jest to sól H3PO4. Stała dysocjacji kwasowej Ka1 tego kwasu na jon H2PO4-:
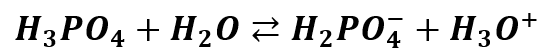
Wynosi 6,92·10-3 (lub pKa1 = 2,16). Stąd stała reakcji hydrolizy jonu H2PO4- wynosi:
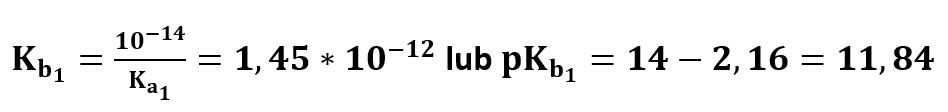
Łatwiej chyba liczyć tym drugim sposobem, prawda? Otrzymaliśmy stałą hydrolizy jonu H2 PO4- oraz jej logarytm. Przyjrzyjmy się ponownie dysocjacji kwasowej jonu H2PO4-:
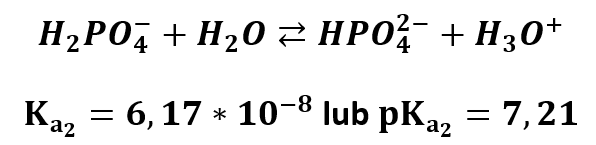
Stała równowagi określa nam w jakim stopniu zachodzi dana reakcja: im jest większa, w tym większym stopniu zachodzi dana reakcja. Jeśli porównamy ze sobą stałą dysocjacji jonu H2PO4- z jego stałą hydrolizy, to widzimy, że większa jest stała dysocjacji. Lub inaczej: 7,21<11,84 – większa jest stała dysocjacji niż hydrolizy. Oznacza to, że jon ten chętniej w wodzie dysocjuje, niż hydrolizuje. Zatem rozpuszczając KH2PO4 w wodzie wprowadzamy jony H2PO4-, które chętniej dysocjują dalej, niż przyjmują proton odtwarzając H3PO4 – zatem będzie przewaga H3O+ w powstałym roztworze, co daje odczyn kwasowy. Dla wprawy poćwiczmy jeszcze razem i udowodnijmy, że K2HPO4 ma odczyn zasadowy.
Rozpuszczamy K2HPO4 w wodzie:
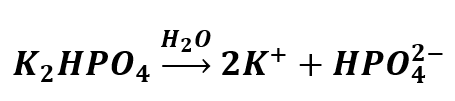
Jon HPO42- może dysocjować dalej z odszczepieniem protonu:
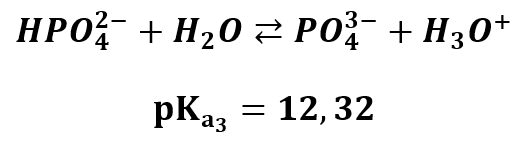
Oraz ulegać protonowaniu w wyniku hydrolizy:
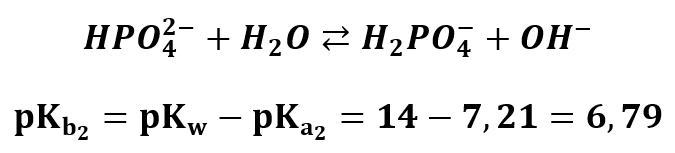
Zatem tym razem stała hydrolizy jest większa niż stała dysocjacji! Bo 6,79<12,32, co oznacza, że stała hydrolizy jest większa od stałej dysocjacji. Jon ten zatem w roztworze chętniej ulega hydrolizie niż dysocjacji, jest mniejsze niż, a co za tym idzie – roztwór ma odczyn zasadowy.
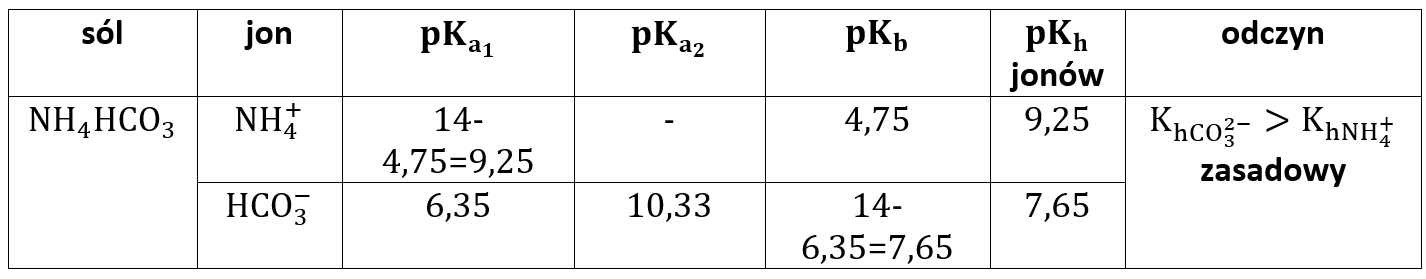
W tabeli poniżej zestawiłem często spotykane wodorosole i odczyny ich wodnych roztworów. Kh oznacza stałą hydrolizy, którą w przypadku soli słabego kwasu jest Kb.
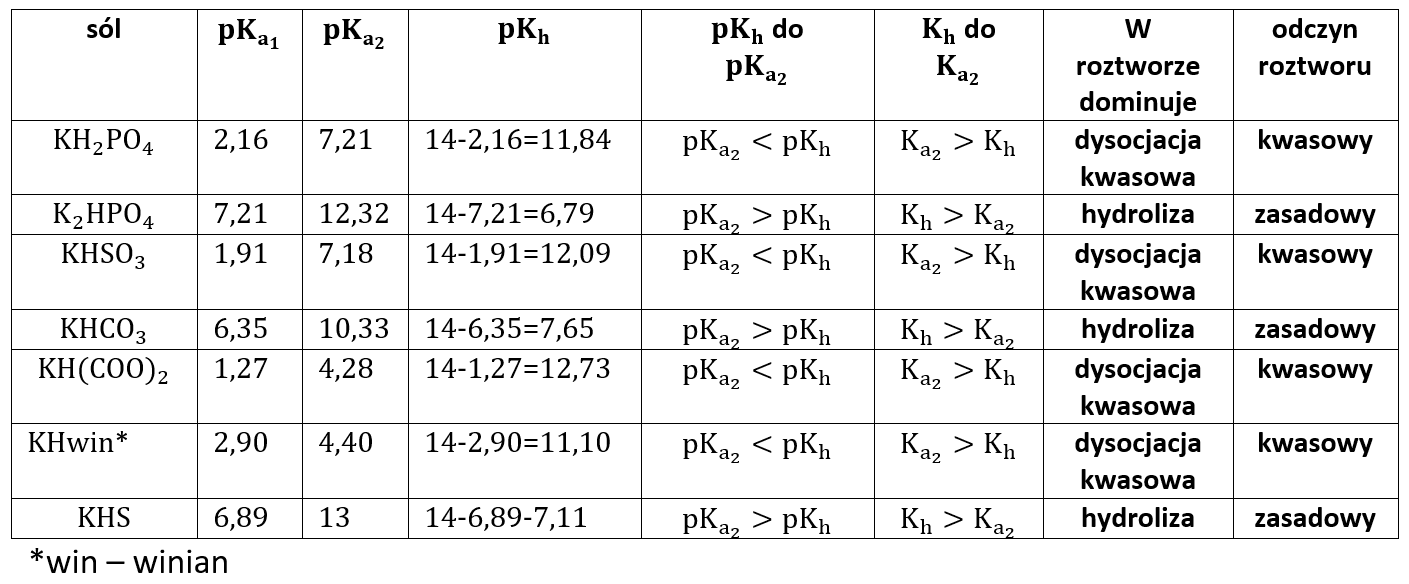
Nie ma tutaj znaczenia, czy używamy soli potasowych czy sodowych, czy jeszcze innych – dopóty rozpatrujemy sole mocnych zasada, nic w tej tabelce się nie zmieni.
Przypadek drugi: wodorosole słabych zasad
Wodorosole mogą się utworzyć w reakcji mocnej zasady zarówno z kwasem słabym, jak i mocnym, a jedynym warunkiem jest oczywiście wielofunkcyjność kwasu, co w tym przypadku oznacza co najmniej dwuprotonowość kwasu. Ale słabe zasady także reagują z ze słabymi zasadami. Ważnymi solami są sole amonowe, a więc skupimy się na nich. Jednym ze składników dodawanych do ciasta są proszki do pieczenia, np. tzw. amoniak do ciasta/amoniak do pieczenia. Chemicznie jest to wodorowęglan amonu NH4HCO3. Jest to dobrze rozpuszczalny w wodzie substancja. Jednakże jaki odczyn wykazują z kolei roztwory tej wodorosoli? Tym razem opiszę to nieco krócej, niż poprzedni przypadek i nauczymy się przewidywania odczynu roztworów drugiego typu wodorosoli.
Zajmijmy się na początek naszym amoniakiem do pieczenia. Rozpuszczamy go w wodzie:
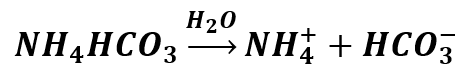
Tutaj mamy z kolei taką ciekawą sytuację, że oba jony mogą ulegać hydrolizie. Jon amonowy ulega hydrolizie kationowej:
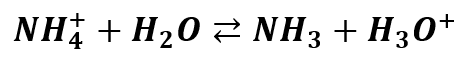
Ta hydroliza odpowiada za zakwaszanie roztworu. Ale już z kolei jon wodorowęglanowy zachowuje się inaczej. Może zarówno dysocjować kwasowo jak i zasadowo (hydrolizować):
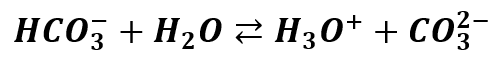
Ponieważ rozpatrywaliśmy już KHCO3 to wiemy, że jon ten chętnie hydrolizuje, więc roztwory kwaśnego węglanu potasu mają odczyn zasadowy. Obecność tego jonów podnosi stężenie jonów OH-, a obecność jonu NH4+ - podnosi stężenie jonów H3O+. Ponieważ oba jony, z których składa się ta sól różnią się stałymi dysocjacji – w różnym stopniu dysocjuje CO2 i NH3 wprowadzone do wody (gdy porównujemy te same stężenia), w różnym stopniu ulegają hydrolizie jony budujące sól. Gdybyśmy sprawdzili pH roztworu tej wodorosoli, okazało by się, że jest lekko powyżej 7, a nawet w okolicach 8. Czy można to udowodnić za pomocą matematyki analogicznie jak poprzednio? Zobaczmy:
Czy można to zrobić proście? Oczywiście, że tak! Przyjrzyjmy się, amoniak w wodzie ulega częściowej reakcji:
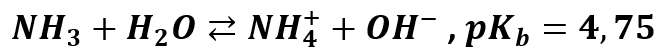
Z kolei dwutlenek węgla ulega takiej reakcji:
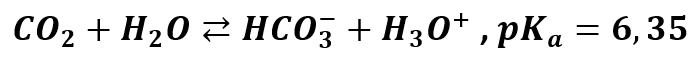
Co więc jest mocniejszym elektrolitem? Amoniak, bo ma niższe pKa, czyli wyższą stała dysocjacji. Amoniak chętniej dysocjuje niż dwutlenek węgla, a to też oznacza, że w wodnym roztworze amoniaku jest więcej jonów, niż w roztworze dwutlenku węgla o tym samym stężeniu. Oznacza to także, że jon NH4+ mniej chętnie ulega hydrolizie niż jon HCO3-. A o odczynie roztworu wodorosoli zadecyduje ten, który którym w większym stopniu ulegnie hydrolizie. Wiemy już, że odczyn będzie zasadowy, bo ze względu na zachodzącą w większym stopniu hydrolizę jonu HCO3- w roztworze pojawi się nadmiar jonów OH-. Zobaczmy więc jak uprości się nasza tabelka:
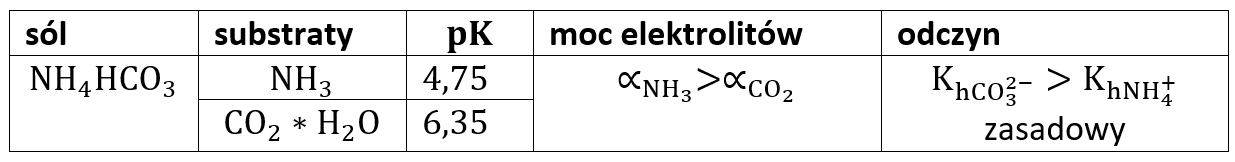
Mówiąc w skrócie: zasada jest mocniejszym elektrolitem, więc przesądza o odczynie zasadowym. Zobaczmy jak to wygląda w przypadku innych wodorosoli słaby kwasów i słabych zasad:
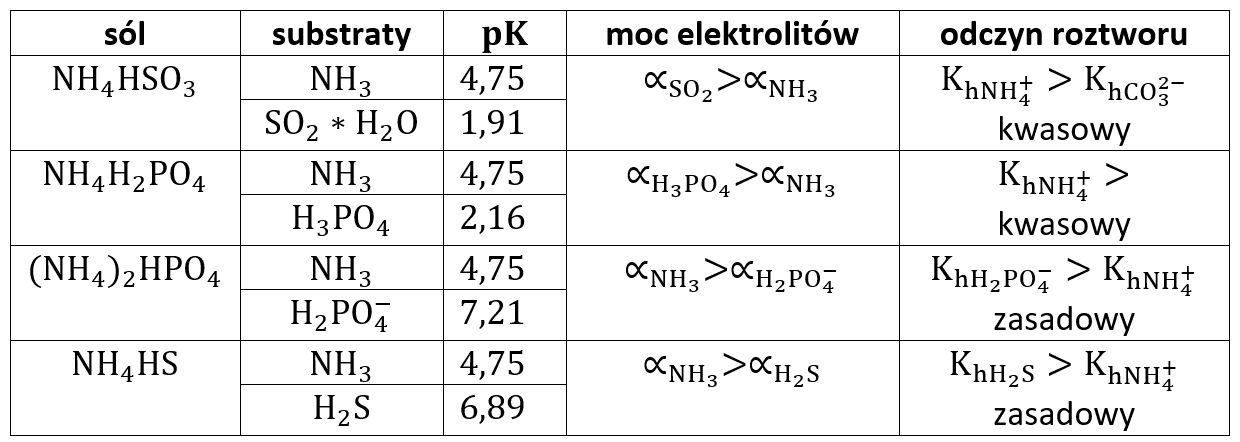
Zauważmy, że odczyn można określić nawet i bez ostatniej kolumny – porównując moc elektrolitów na podstawie samych wartości pKa. Czy można trafić na wodorosól, której r-r będzie miał odczyn obojętny? Oczywiście, jeśli tylko pKh=pKa2 lub jeśli pKa=pKb. Oczywiście słabe zasady to nie tylko amoniak, to także aminy organiczne, hydroksyloamina, hydrazyna, a także sole słabych wodorotlenków. Ale już wiemy jak sobie z nimi poradzić.
Fotografia w miniaturze artykułu: linaryt, autor: Christian Rewitzer