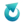Zadanie z chemii z działu: Stechiometria
W celu oznaczenia udziału (w % masowych) NH4NO3 w nawozie zawierającym wyłącznie NH4NO3 i KNO3, próbkę o masie 2,000 g rozpuszczono w wodzie i wprowadzono do roztworu z nadmiarem KOH. Zaszła wtedy reakcja chemiczna opisana równaniem:
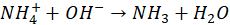
Z roztworu poreakcyjnego usunięto cały amoniak, który następnie pochłonięto w płuczce zawierającej 50 cm3 wodnego roztworu H2SO4 o stężeniu 0,1000 mol/dm3. Nadmiar H2SO4 został odmiareczkowany roztworem NaOH o stężeniu 0,1000 mol/dm3. Do osiągnięcia punktu końcowego zużyto 75,0 cm3 roztworu NaOH.
Oblicz, jaki jest udział masowy NH4NO3 w badanym nawozie sztucznym. Wynik podaj w %.
Przykładowe rozwiązanie
Całkowita liczność kwasu siarkowego(VI) w roztworze użytym do adsorpcji:
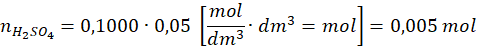
Podczas miareczkowania zobojętniono nadmiar kwasu:
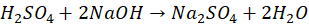
który wynosi połowę liczności zużytego NaOH:
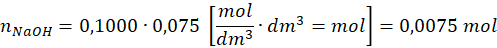
Zatem w nadmiarze było 0,00375 mol H2SO4.
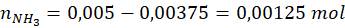
1 mol powstałego (NH4)2SO4 odpowiada 2 mol NH4NO3 z pierwotnego nawozu → próbka zawierała 0,0025 mol NH4NO3
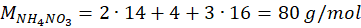
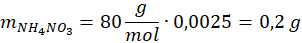
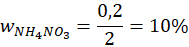
Odp: 10%