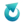Zadanie z chemii z działu: Chemia nieorganiczna (pierwiastki bloków s, p, d)
W 20 °C rozpuszczalność Na2CO3 i NaHCO3 (w 100 g wody) wynosi odpowiednio 21,5 i 9,6 g. W temperaturze 20 °C przygotowano nasycony roztwór Na2CO3 przez rozpuszczenie 1 mola Na2CO3 w odpowiedniej ilości wody. Następnie, w zestawie uniemożliwiającym opuszczanie układ przez wodę na drodze parowania, przez roztwór przepuszczano gazowy CO2, aż przyrost masy zawartości naczynia wyniósł 44 g. Wydzielony krystaliczny osad odsączono i wysuszono. Wszystkie operacje wykonano nie zmieniając temperatury. Podczas przepuszczania CO2 przez roztwór zaszła reakcja, której równanie przedstawiono poniżej.
Zadanie 1
Oblicz wydajność otrzymywania NaHCO3 opisaną metodą. Załóż, że masa otrzymanego suchego NaHCO3 otrzymanego po odsączeniu i wysuszeniu ciała stałego jest równa masie wydzielonych kryształów. Przyjmij masy molowe: Na2CO3 – 106 g·mol-1, NaHCO3 – 84 g·mol-1, CO2 – 44 g·mol-1. Wynik podaj w procentach z dokładnością do jedności.
Zadanie 2
Rozstrzygnij, czy prawdziwe jest poniższe stwierdzenie. Wybierz i podkreśl rozstrzygnięcie z podanych w nawiasie i uzasadnij swój wybór.
Twierdzenie: otrzymana masa kryształów świadczy o tym, że reakcja pomiędzy roztworem węglanu sodu a tlenkiem węgla(IV) zaszła w mniej niż 80%.
Twierdzenie (jest / nie jest) prawdziwe, ponieważ
……………………………………………………………………………………………………
Zadanie 1
poprawna odpowiedź:
W=73%
Zadanie 2
poprawna odpowiedź:
Twierdzenie (jest / nie jest) prawdziwe, ponieważ