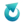Zadanie z chemii z działu: Chemia analityczna
Kwas fosforowy(V) (H3PO4) jest słabym kwasem trójprotonowowym, a zdolność do odszczepienia kolejnych kationów wodoru jest silnie zróżnicowana. Z wodorotlenkami litowców można otrzymać 3 typy soli: diwodoroortofosforany(V), wodoroortofosforany(V) i ortofosforany(V). Wodne roztwory diwodorofosforanu(V) sodu mają odczyn lekko kwasowy. Z kolei roztwory wodorofosforanu disodu mają odczyn lekko zasadowy, co można potwierdzić za pomocą wskaźnika I. Trzecią solą jest fosforan trisodu, którego wodne roztwory mają silnie zasadowy odczyn.
Poniżej przedstawiono barwy, jakie przyjmują dwa wskaźniki kwasowo-zasadowe w zależności od pH i zakres zmiany barwy.
Zadanie 1
Oceń prawdziwość zdań. Zaznacz P, jeśli informacja jest prawdziwa, alfo F, jeśli jest fałszywa.
| Wskaźnikiem I jest wskaźnik uniwersalny. | P | F |
Wobec wskaźnika I można oznaczać kwas fosforowy w reakcji z mianowanym roztworem NaOH, której sumaryczne równanie można zapisać jako: 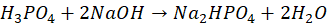 | P | F |
| Podczas miareczkowania wodnym roztworem NaOH wodnego roztworu H3PO4 z dodatkiem wskaźnika II, zmiana barwy wskaźnika z czerwonej na żółtopomarańczową oznacza, że został osiągnięty stosunek molowy kwasu do zasady 1 : 1. | P | F |
Zadanie 2
Rozstrzygnij, czy możliwe jest oznaczenie stężenia roztworu kwasu fosforowego(V) poprzez miareczkowanie mianowanym roztworem wodorotlenku potasu, gdy punkt końcowy miareczkowania odpowiada otrzymaniu roztworu K3PO4. Przyjmij, że miareczkowanie prowadzone jest wobec wskaźnika I.
Rozstrzygnięcie:………………………..
Zadanie 3
Z roztworu H3PO4 pobrano pipetą 100 cm3 przeniesiono do kolby stożkowej. Następnie dodano 2 krople alkoholowego roztworu wskaźnika I i miareczkowano roztworem wodorotlenku potasu momentu, aż zawartość kolby przyjęła trwałe różowe zabarwienie. Wkroplono 40 cm3 roztworu wodorotlenku potasu. Do drugiej kolby stożkowej wprowadzono za pomocą pipety 100 cm3 tego samego roztworu H3PO4, dodano 2 krople alkoholowego roztworu wskaźnika II i miareczkowano tym samym roztworem wodorotlenku potasu do zmiany barwy wskaźnika z czerwonej na żółtopomarańczową.
Napisz, jaką objętość roztworu KOH wprowadzono do kolby w chwili, gdy nastąpiła opisana zmiana barwy wskaźnika.
…………………………………………………………………………………………………
Zadanie 4
Ze względu na daleko posuniętą hydrolizę wodne roztwory Na3PO4 mają odczyn silnie zasadowy. Z kolei fosforan wapnia Ca3(PO4)2 jest związkiem bardzo trudno rozpuszczalnym w wodzie. Stężenie jonów wapnia i jonów fosforanowych w roztworze nad osadem tej soli jest znikome, a więc odczyn nasyconego roztworu Ca3(PO4)2 (tj. cieczy nad osadem Ca3(PO4)2) jest bliski obojętnego. Kwas fosforowy można oznaczyć inaczej, osiągając stosunek molowy kwasu do zasady 1 : 3. W tym celu, jeszcze przed rozpoczęciem miareczkowania, do badanego roztworu dodaje się roztworu chlorku wapnia w takiej ilości, by stanowiła on nadmiar w stosunku do kwasu fosforowego obecnego w roztworze. Następnie rozpoczyna się wkraplanie zasady. W miarę dodawania zasady w roztworze rośnie stężenie anionów kwasu fosforowego o coraz większym ładunku ujemnym.
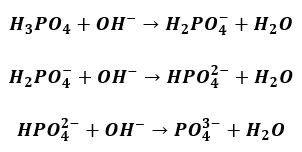
Już niewielkie stężenie jonów fosforanowych powoduje, że reagują one z obecnymi w roztworze jonami wapnia wg równania:
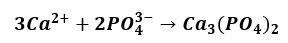
W ten sposób aniony fosforanowe są na bieżąco usuwane z roztworu, co zapobiega zbytniemu podnoszeniu pH mieszaniny reakcyjnej wskutek hydrolizy powstających fosforanów. Strącenie osadu zachodzi do momentu, w którym w układzie zabraknie niezobojętnionego kwasu. Miareczkowanie prowadzi się w obecności wskaźnika I do pojawienia się trwałego różowego zabarwienia, co oznacza punkt końcowy.
Napisz w postaci cząsteczkowej sumaryczne równanie reakcji, która zachodzi podczas wkraplania roztworu KOH do roztworu H3PO4 z dodatkiem CaCl2 do chwili pojawienia się trwałego różowego zabarwienia zawartości kolby.
…………………………………………………………………………………………………….
Zadanie 5
Podczas miareczkowania próbki kwasów fosforowego w obecności jonów wapnia i wskaźnika I zużyto 60 cm³ roztworu wodorotlenku potasu.
Napisz jaką objętość roztworu wodorotlenku potasu zużyto podczas miareczkowania tej próbki bez dodatku jonów wapnia do osiągnięcia trwałego różowego zabarwienia.
………………………………………………………………………………………………………
Zadanie 6
Podczas dodawania roztworu Ca(NO3)2 do zlewki zawierającej wodny roztwór K3PO4 zachodzi reakcja opisana równaniem:
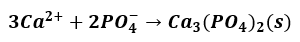
Dokończ zdania. Wybierz i pokreśl po jednym określeniu z każdego nawiasu.
W czasie reakcji pomiędzy fosforanem(V) potasu a azotanem(V) wapnia pH fazy wodnej (ulega obniżeniu / ulega podniesieniu / nie zmienia się). W tej sytuacji wskaźnikiem całkowitego przereagowania K3PO4 (może / nie może) być wskaźnik I.
Zadanie 1
Poprawna odpowiedź:
| Wskaźnikiem I jest wskaźnik uniwersalny. | P | F |
Wobec wskaźnika I można oznaczać kwas fosforowy w reakcji z mianowanym roztworem NaOH, której sumaryczne równanie można zapisać jako: 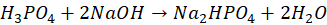 | P | F |
| Podczas miareczkowania wodnym roztworem NaOH wodnego roztworu H3PO4 z dodatkiem wskaźnika II, zmiana barwy wskaźnika z czerwonej na żółtopomarańczową oznacza, że został osiągnięty stosunek molowy kwasu do zasady 1 : 1. | P | F |
Zadanie 2
poprawna odpowiedź:
Rozstrzygnięcie: NIE
Zadanie 3
poprawna odpowiedź:
20 cm3
Zadanie 4
poprawna odpowiedź:
2H3PO4 + 6KOH + 3CaCl2 → Ca3(PO4)2(s) + 6KCl + 6H2O
Uwaga: symbol (s) albo ↓ przy wzorze Ca3(PO4)2 nie jest obowiązkowy.
Zadanie 5
poprawna odpowiedź:
40 cm3
Zadanie 6
W czasie reakcji pomiędzy fosforanem(V) potasu a azotanem(V) wapnia pH fazy wodnej (ulega obniżeniu / ulega podniesieniu / nie zmienia się). W tej sytuacji wskaźnikiem całkowitego przereagowania K3PO4 (może / nie może) być wskaźnik I.