Już od początku naszej nauki chemii spotykamy się z pojęciem powłoki walencyjnej i elektronów walencyjnych. I wtedy często dowiadujemy się, że powłoka walencyjna to ta ostatnia powłoka, a elektrony walencyjne to elektrony obsadzające tę powłokę. Bo to te eletrony biorą udział w reakcjach chemicznych. Potem jednak sprawa się robi się bardziej skomplikowana, bo okazuje się, że w reakcjach chemicznych biorą udział elektrony nie tylko z powłoki ostatniej, ale także z powłok niższych, np. z podpowłoki 3d w czwartym okresie. Jak pisałem wcześniej tutaj: myślenie o powłokach elektronowych sprowadza nasze myślenie o budowie atomu do czasów, gdy budowę wszechświata tłumaczono istnieniem sfer niebieskich. Ponieważ od czasów Kopernika astronomia poszła sporo do przodu i pojęcie sfer niebieskich okazało się herezją, to tak samo powłoki (sfery) elektronowe są herezją. A przynajmniej stało się herezją wskutek niedomówień. Właściwiej jest więc mówić o poziomach i podpoziomach energetycznych, niż o powłokach i podpowłokach elektronowych. A więc możemy wyróżnić poziomy i podpoziomy walencyjne. Ale i w tym artykule kilka razy termin powłoka zostanie użyty.
A czy zastanawialiśmy się kiedyś, czym właściwie jest ta walencyjność poziomu? Co w ogóle znaczy słowo walencyjny? Dziwny ten przymiotnik pojawia się tylko przy mowie o poziomach/powłokach walencyjnych czy elektronach walencyjnych. Jak już wspomniałem, walencyjny często utożsamiany jest z ostatnią powłoką lub elektronami na niej. Takie utożsamienie podaje zresztą słownik języka polskiego PWN:

Czy rzeczywiście słowo walencyjny oznacza po prostu, że coś jest najbardziej na zewnątrz? Czy w takim razie o skórce jabłka powiedzieć, że jest jego powłoką walencyjną, bo jest najbardziej na zewnątrz? Sam miałem zresztą okazję spotkać się z argumentacją, że elektrony walencyjne to elektrony ostatniej powłoki, bo walencyjny oznacza najbardziej na zewnątrz. Czy też w przypadku atomu w takim znaczeniu jest to słowo używane, ale może oznacza jednak coś innego? Dlaczego więc słowa walencyjny nie używamy szerzej, a konkretnie tylko w odniesieniu do poziomu subatomowego? A może chodzi o coś innego, niż najbardziej na zewnątrz? Skąd w ogóle wzięło się to słowo?
Musimy zdać sobie sprawę z tego, że każda nauka posługuje się jakimiś terminami, czyli odpowiednim nazewnictwem. W miarę rozwoju nauki pojawiają się kolejne terminy, ale stare też ulegają zmianom. Pewne terminy wychodzą z użycia, a inne funkcjonują nadal, ale czasem są zastępowane nowymi nazwami. Nawet nazwy pierwiastków ulegały zmianom. I tak po łacinie chlor początkowo nazwano murium, a kwas solny zwano acidum muriaticum - do dziś w niektórych językach można spotkać tę nazwę kwasu solnego, np. w języku angielskim jest muriatic acid, co jest nazwą zamienną z hydrochloric acid. Z kolei wolfram, zanim został wolframem był zwany tungstenem i ta nazwa do dziś jest obowiązujaca w kilku językach. Zmiany nie omijały i polskich nazw pierwiastków o rodzimych korzeniach: wodoród został wodorem, kwasoród tlenem (od tlenienia/tlenia się np. ogniska), a saletroród został azotem. Z kolei krzemno stało się krzemem. Ale zmiany nie obejmowały tylko nazewnictwa pierwiastków czy związków, co i inne terminy.
I tak nie każdy dziś zdaje sobie sprawę z tego, że gdy do użycia wszedł mol, to pierwszy przymiotnik od niego utworzony w języku polskim brzmiał molarny - utworzony na podobnej zasadzie jak przymiotniki: popularny, wulgarny czy bardziej związany z chemią: elementarny (zamiast: elementowy, elementny). I tak masę molową zwano kilkadziesiąt lat temu masą molarną, a objętość molową - objętością molarną. Podobnie stężenie molowe zwano dawniej stężeniem molarnym. Albo inaczej molarnością roztworu, którą dziś zwiemy molowością. Z czasem po prostu przymiotnik ten zyskał bardziej spolszczoną formę: molowy zamiast molarny. I tak masa molarna stała się masą molową. A sfery elektronowe stały się powłokami lub warstwami elektronowymi. A co z tą walencyjnością?
Przez te zmiany w nazewnictwie chyba nawet najstarsi górale z Jawornika (doliny długowieczności) nie pamiętają, że wartościowość zwano dawniej m.i. WALENCYJNOŚCIĄ lub walentnością, a słowo ma swoje źródło w łacińskim valentia. Porównajmy je zresztą ze słowami value i valency w języku angielskim. Do dziś zresztą używane jest czasem słowo: walentny, czyli mający wartość, albo mówi się np. szczepionka X-walentna. A nasi południowi sąsiedzi? Ci, z których mowy lubimy się śmiać, m.i. dlatego, że pozbyli się wielu zapożyczeń ze swojego języka (dlatego teatr to divadlo, a szpital to nemocnice), do dziś używają słowa valence na wartościowość. O dziwo - nie zamienili go na czeski odpowiednik. Nazwa ta zresztą spotykana jest także w południowych językach słowiańskich, więc w tym konkretnym przypadku to nie język czeski, ale właśnie polski jest wyjątkiem wśród słówiańskich, bo jako jedyny pozbył się zapożyczenia. Nawet nasi wschodni sąsiedzi mają waljentnist. W polskim nazewnictwie wymieniono pochodzący z łaciny rzeczownik na polski odpowiednik, ale nie zrobiono tego samego z przymiotnikiem od niego pochodzącym w konsekwentnym zakresie, bo przymiotnik "wartościowy" jest używany w polskiej terminologii chemicznej, ale w innym kontekście niż "walencyjny". Stąd nie każdy wiąże od razu ze sobą, że powłoka jest walencyjna, bo odnosi się to do udziału w reakcjach elektronów z tej powłoki i WARTOŚCIOWOŚCI pierwiastka. Są to rzeczy ściśle ze sobą związane. A więc walencyjny, bo ma związek z wartościowością, ale nie, że walencyjny, bo najbardziej na zewnątrz. Ponadto w reakcjach chemicznych biorą udział nie tylko elektrony z ostatniej powłoki. W przypadku pierwiastków bloku energetycznego d biorą w nich także udział także elektrony przedostatniego poziomu (powłoki), a więc przedostatnia powłoka ma związek z wartościowością pierwiastka. Widzimy więc przeto, że utożsamienie walencyjny=najbardziej oddalony - jest błędne, bo termin walencyjny nawiązuje do czego innego.
Skoro walencyjny ≠ najbardziej oddalony, to oznacza, że jeśli atom np. sodu pozbędzie się swojego elektronu z powłoki wartościowości (walencyjnej) i utworzy kation Na+, to powłoka L - nowa ostatnia powłoka, nie staje się jego nową powłoką walencyjną. Bo ta nie bierze udziału w reakcjach chemicznych sodu. Kation sodu jest rdzeniem atomowym, a rdzeń atomowy nie bierze udziału w reakcjach chemicznych. Dlatego wyróżniamy rdzeń i poziomy walencyjne, czyli wartościowości. Jak widzimy zabieg wymiany terminu na bardziej polski odpowiednik zaowocował tym, że nie wiążemy automatycznie rzeczownika z przymiotnikiem. A to skutkuje tym, że czasem można spotkać kontrowersje wokół tego, które poziomy energetyczne i które elektrony zaliczyć do walencyjnych? Tak, to właśnie skutkuje, bo gdyby przeprowadzić sondę, to się okaże, że mało który chemik wiąże słowo walencyjny z wartościowy. Tu jestem ciekaw, czy nasi sąsiedzi mają podobne dylematy edukacyjne, skoro do dziś mają walentność.
Jeśli nawiązaliśmy do wartościowości, to kolejnym problemem jest wyjaśnić, czym zatem jest wartościowość? Wielu chemików mogłoby zauważyć, że tego pojęcia prawie nie używa. Bo rzeczywiście rzadko jest w praktyce potrzebne. Ale jest tradycyjnym elementem w edukacji chemicznej, i - często mamy zagwozdkę, czym ona jest? Często mówimy np. że pierwiastek jest dwuwartościowy, ale czym jest sama wartościowość? Pod tym pojęciem rozumiemy liczbę wiązań (jonowych lub kowalencyjnych), którą dany atom tworzy z innymi atomami, i to by była pierwsza definicja. (1). Ot, w cząsteczce CO2 atom węgla jest czterowartościowy, bo tworzy 4 wiązania z atomami tlenu.
A jednak pomimo tej w miarę prostej definicji pojecie sprawia wiele problemów. A jak to odnieść do związków kompleksowych? Poza związkiem z wartością łacińskie valentia oznacza także pojemność. Jeśli przyjrzymy się cząsteczkom ułożonym w szeregu: HF, H2O, NH3, CH4 to widzimy, że każdy atom ma jakąś "pojemność" - może połączyć z pewną liczbą atomów wodoru. Tak, aż się nasyci. I do tego właśnie nawiązuje kolejna definicja, podawana przez IUPAC (2):
(2) Maksymalna liczba jednowartościowych atomów, z którą może się związać atom rozważanego pierwiastka lub rozważany fragment cząsteczki, lub liczba tych atomów, na którą można wymienić atom danego pierwiastka.
Pierwotnie tymi jednowartościowymi atomami były wodór lub chlor. Z definicji tej wynika, że atom węgla w cząsteczce CO2 jest czterowartościowy (jego pojemność wynosi 4 atomy wodoru, więc czteropojemnościowy?), bo atomy tlenu można zastąpić 4 atomami wodoru lub chloru.
Równoległa definicja (3) mówi, że to:
(3) Liczba atomów wodoru, z którą wiąże się atom rozważanego pierwiastka w związku z wodorem, lub podwojona liczba atomów tlenu, z którą się wiąże się atom rozważanego pierwiastka w tlenku. I tak w przypadku CO2 znowu otrzymamy IV.
I kolejne definicje:
(4) Liczba elektronów na poziomach walencyjnych pomniejszona o liczbę elektronów niewiążących.
(5) Liczba wiązań powiększona o ładunek formalny atomu.
W przypadku CO2 wg wszystkich definicji atom węgla jest czterowartościowy - ma pojemność 4 atomów wodoru itd. Ale sytuacja komplikuje się już w tak prostych przypadkach, jak HNO3 czy NH4+. Atom azotu tworzy bowiem maksymalnie 4 wiązania. I zgodnie z pierwszą koncepcją jest czterowartościowy w cząsteczce HNO3 czy jonie NH4+. Ale już wg definicji (5) jest pięciowartościowy nie tylko w cząsteczce HNO3, ale nawet w jonie NH4+(!), gdzie mamy 4 wiązania! Ale za to wykorzystane wszystkie elektrony (nomen omen) walencyjne... Można spotkać stwierdzenie, z którym się zresztą zgadzam, że azot ma maksymalną wartościowość 4, a 5, to jego maksymalny stopień utlenienia. Zresztą liczba V w nazwie kwas azotowy(V) czy innych nazwach w systemie Stocka nie oznacza wartościowości, jak często myślimy, tylko właśnie stopień utlenienia. Z tego też powodu powodu podajemy liczbę 0 w nazwie pantakarbonylku żelaza: Fe(CO)5 to pentakarbonylek żelaza(0) - bo zero odnosi się do stopnia utlenienia żelaza, a nie do jego wartościowości, która wcale nie wynosi 0 w przypadku żelaza. Sami widzimy, że pojęcie wartościowości jest bardziej zawiłe, niż przymiotnik walencyjny, który tej wartościowości dotyczy. No mniej rozbieżności mamy, gdzy chemy wskazać, które elektrony lub które poziomy i podpoziomy są walencyjne.
I tak w bloku s: są to elektrony na ostatnim podpoziomie s: 1s dla H, 2s dla Li, 4s dla K itd. Dalej: 4s dla Ca, 5s dla Sr. I tak atomy litowców i wodoru mają po 1 elektronie wartościowości (celowo napisałem tak, zamiast walencyjny). Bo to ten podpoziom ("podpowłoka") bierze udział w reakcjach chemicznych.
W bloku p są to elekrony na podpoziomach s+p ostatniego poziomu, bo to elektrony z tych poziomów biorą udział w reakcjach chemicznych. I tak atom N ma 5 elektronów wartościowości (walencyjnych), tlenu i siarki po 6, glinu 3, a chloru 7.
Ale w bloku d, że nie wspomnę już o f - sprawa się komplikuje. Ot, w wypadku np. Mn - w reakcjach biorą udział nie tylko elektrony z podpoziomu 4s, ale także z podpoziomu 3d. Łączna liczba elektronów obsadzających te podpoziomy w stanie podstawowym wynosi 7 w przypadku manganu. Dla atomu żelaza mamy ich 8, bo mamy 3d64s2. Liczba elektronów walencyjnych (wartościowości) wynosi 7 dla atomu Mn, a 8 dla atomu Fe. Zauważmy, że to, że liczba tych elektronów, choć związana z wartościowością - nie musi pokrywać się z wartościowością pierwiastka w danym związku. Ot, atom Mn ma ich 7, ale nie we wszystkich związkach Mn jest siedmiowartościowy. A w wypadku atomu Fe jest ich 8, ale żelazo nie ma tak wysokiej wartościowości, bo nie wszystkie elektrony walencyjne biorą udział w reakcjach chemicznych.
Dodatkowego komentarza wymagają dwie grupy układu okresowego. Co z grupą XI i XII?
W przypadku miedzi wiemy, że jej najtrwalszy kation to Cu2+. Aby taki kation utworzyć potrzeba usunąć po jednym elektronie z poziomów 4s i 3d atomu elementarnej miedzi. Jest więc jasne, że walencyjne podpoziomy to nie tylko 4s, ale także 3d i łącznie mamy walencyjnych elektronów 11. Ale co w przypadku srebra? Tu wszyscy uczymy się o kationie Ag+. Rzeczywiście jest on trwały. Czy to oznacza, że atom srebra ma tylko 1 elektron walencyjny? Nie, bo srebro tworzy związki nie tylko na pierwszym stopniu utlenienia. Znane są znacznie mniej trwałe związki miedzi(III) i Ag(III). A w przypadku Au to związki Au(III) są trwalsze niż Cu(III) czy Ag(III), które są bardzo silnymi utleniaczami (bo są nietrwałe i maja niekorzystną konfigurację - łatwo się redukują do Cu2+ i Ag+) Zatem w grupie XI atomy Cu, Ag, Au, a i zapewne nie tak dawno odkrytego rentgenu (Rg) mają po 11 elektronów walencyjnych. Poniższy rysunek pokazuje, które poziomy zaliczamy do walencyjnych.
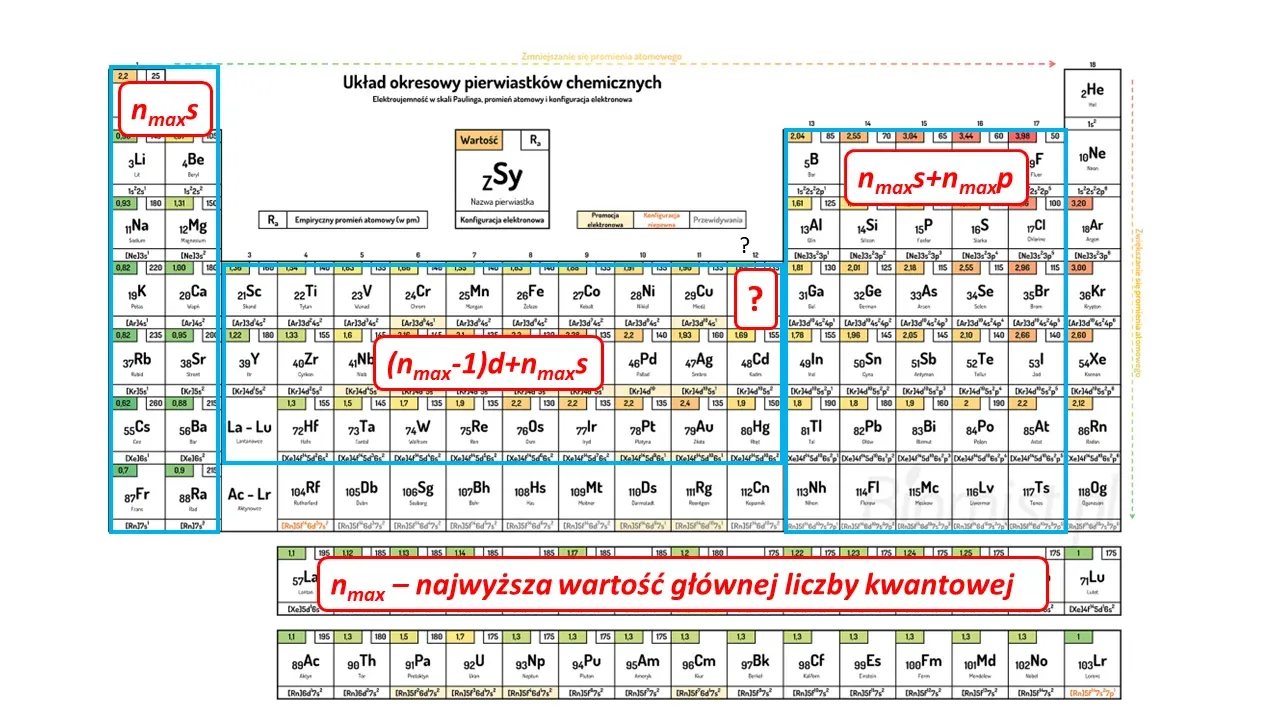
Nasze układy okresowe pierwiastków można pobrać tutaj.
Czy konsekwentnie w grupie XII sprawa wygląda tak, że mamy po 12 elektronów walencyjnych? Otóż sprawa wygląda tak, że w przypadku kadmu czy rtęci nie mamy wątpliwości: znane są związki Cd(III) i Cd(IV), czy Hg(III) i Hg(IV) - więc poziom 4d i 5d zalicza się do walencyjnych, łącznie elektronów walencyjnych jest 12. Ale gdy znacznie mniejszy atom cynku odda 2 elektrony z podpoziomu 4s, to uzyskuje bardzo trwałą konfigurację: [Ar]3d10. Położone bliżej jądra elektrony z podpoziomu 3d trudniej ruszyć. Nie są znane związki cynku na stopniu utlenienia wyższym niż II. Wynika stąd niejasność, czy w przypadku cynku podpoziom 3d zaliczać do walencyjnych, konsekwentnie jak dla innych grup z bloku d? A liczba elektronów walencyjnych dla atomu cynku wynosi w takim razie 2 czy 12? Nie ma jedności w tej kwestii w świecie akademickim. Ale konsekwencja nakazywałaby, aby go nie zaliczać! I wtedy atom cynku miałby tylko 2 elektrony walencyjne, a nie 12 jak Cd czy Hg. I z tym się zgadzam: jeśli nie można "przekonać" podpoziomu 3d do udziału w reakcjach chemicznych, to te elektrony nie należą do walencyjnych. Istnieje, i to od niedawna, tylko jedna praca naukowa, wg której, w obecności odpowiednio silnego utleniacza - teoretycznie możliwe jest otrzymanie związków Zn(III) a może nawet i Zn(IV) [1]. A to by oznaczało, że jednak trzeba podpoziom 3d zaliczać do walencyjnych, ale póki co nikomu w praktyce nie udało się otrzymać związków Zn(III) czy Zn(IV). A póki nie ma odpowiedzi, czy faktycznie da się takie związki cynku otrzymać - to nie ma potrzeby, by sobie tym cynkiem zawracali głowę uczniowie, ani nauczyciele uczniom - nie bez powodu nikt o ten cynk nie pytał np. na maturze. Oczywiście w zbiorach zadań czy w innych opracowaniach spoza uprawnionych jednostek egzaminacyjnych można znaleźć takie rzeczy, ale pamiętajmy, że nie rozwiązuje się zadań na siłę - część można, a niektóre to i nawet trzeba sobie odpuścić. Niektóre rozwiązywane na siłę lubią się mścić - nie rozwiazuje się wadliwych zadań. Zagwozdkę możemy mieć także w przypadku helu.
Zwróćmy też uwagę na słowa walencyjny i kowalencyjny - to drugie słowo mozna przetłumaczyć jako: współwartościowe. O atomie węgla w cząsteczce CO2 możemy powiedzieć, że jest czterowartościowy, albo czterowalencyjny/czterowalentny. I w sumie na tym można ten krótki artykuł zakończyć :)
PS a gdy już ktoś otrzyma związki cynku(III) lub cynku(IV), to na pewno dam Wam cynk.
Realization of the Zn3+ oxidation state"; Nanoscale, 2021 (13), str. 14041-14048