Zanim zaczniemy wspomnę tylko, że niektórzy nie potrafią zbilansować równania redukcji nitrobenzenu do aniliny, bo dochodzą do sprzeczności. Dlaczego dochodzą do sprzeczności? To sobie wyjaśnimy na samym końcu.
Choć w tym artykule skupimy się na związkach organicznych i pewnych problematycznych, albo nieoczywistych reakcjach redoks, to rzecz jasna podział na związki organiczne i nieorganiczne jest sztuczny i objawem wstecznictwa. Poruszone zagadnienia dotyczą tak samo związków organicznych, jak i nieorganicznych.
Pierwszą nieoczywistą reakcją redoks, którą sobie rozpatrzymy, jest nitrowanie arenów. Sumaryczne równanie reakcji nitrowania benzenu wygląda tak:
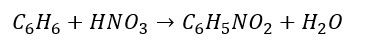
Ale choć często nie zdajemy sobie z tego sprawy, to ta reakcja jest reakcją redoks. A jak reakcja redoks, to i równania połówkowe… Jak zapisać równania reakcji utleniania i redukcji? Musimy wprowadzić grupę NO2 do cząsteczki benzenu jednocześnie usuwając atom wodoru. Jak zacząć zapisywanie równań połówkowych? Zacznijmy od wygenerowania indywiduum, które przyłączy się do cząsteczki benzenu w miejsce atomu wodoru:
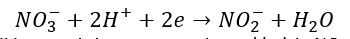
I mamy równanie redukcji i mamy już grupę atomów o składzie NO2. Następnie podstawiamy ja za 1 z atomów wodoru:
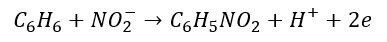
I mamy równanie utleniania! Po dodaniu reakcji połówkowych otrzymujemy:
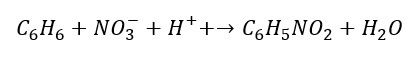
Czyli w zapisie cząsteczkowym:
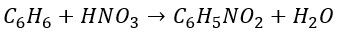
I teraz się zacznie: „Co ten Mickiewicz znowu wymyślił! Innych poucza, a sam nie wie, że w reakcji nitrowania benzenu bierze udział jon nitroniowy NO2+, a nie azotanowy(III)! Tak zgadzam się z tym, napisałem nieprawdę. I wiem o tym. A jednak ją napisałem.
Pójdźmy dalej. Jeśli napiszę równanie reakcji redukcji podczas utleniania alkoholi zakwaszonym roztworem dichromianu potasu:
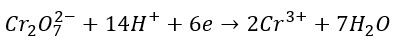
To napiszę tak samo prawdziwą, czyli nieprawdziwą informację o tej reakcji, jak w przypadku nitrowania. „Jak to! Przecież każdy powinien wiedzieć, że aniony dichromiannowe są silnymi utleniaczami i redukują się do kationów Cr3+!”
Tak to prawda, redukują się, a jednak napisałem nieprawdę. I to w obu przypadkach. Wynika to stąd, że to nie aniony dichromianowe(VI) działają utleniająca na alkohole, tylko aniony wodorochromianowe(VI), które powstają w układzie reakcyjnym. Po silnym zakwaszeniu wodnego roztworu dichromianu(VI) potasu ustala się równowaga:
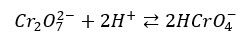
O tym, że taka równowaga ustala się w zakwaszonym roztworze dichromianu potasu świadczy kolor mieszaniny. Po dodaniu silnego kwasu do wodnego roztworu dichromianu potasu obserwujemy zmianę barwy z pomarańczowej na niemal czerwonopomarańczową. I to ten anion atakuje cząsteczkę alkoholu. Czyli właściwym utleniaczem nie jest anion dichromianowy!
Dlaczego zatem w równaniu połówkowym tego nie uwzględniamy? Bo równania połówkowe to fikcja. One nie odzwierciedlają w żaden sposób ścieżki procesu. Są tylko informacją o jego stechiometrii. O stanie początkowym i o stanie końcowym, a nie o mechanizmie reakcji. Tak więc tak samo jak w reakcji nitrowania benzenu nie bierze udziału anion azotanowy(III), tylko nitroniowy, to tak samo anion dichromianowy nie bierze udziału w reakcji utleniania alkoholi. I korzystając z tego samego prawa, wg którego zapisujemy równanie połówkowe z anionem dichromianowym, tak samo możemy zapisać równanie redukcji anionu azotanowego(V) do azotanowego(III) w przypadku nitrowania arenów.
Co więcej, to gdy wiemy, że równania połówkowe są fikcją, to w części przypadków równanie jednej reakcji połówkowej możemy zapisać na więcej niż jeden sposób. I jest to legitne. Ale o tym to za chwilę. Teraz wyjaśnijmy sobie raz na zawsze, że związki nitrowe nie są pochodnymi kwasu azotowego(V). Nie są. Gdyby były pochodnymi kwasu azotowego.(V), to byśmy je nazywali azotanami(V), a nie związkami nitrowymi. Błędne jest myślenie, że nitrobenzen jest pochodną kwasu azotowego(V), bo w reakcji jego otrzymywania użyto kwasu azotowego(V). To jest tylko metoda, którą go otrzymano. Ale związki nitrowe otrzymuje się także w innych reakcjach. Nitrowanie węglowodorów aromatycznych przebiega według mechanizmu substytucji elektrofilowej, stąd w reakcji potrzebny jest kwas azotowy(V), bo jest on źródłem kationu nitroniowego - właściwego elektrofila.
W innych przypadkach związki te można otrzymać albo według mechanizmu rodnikowego lub nukleofiwego. Nitrowanie alkanów prowadzi się w fazie parowej. Pary kwasu azotowego(V) i odpowiedniego alkanu reagują ze sobą, tworząc nitroalkany. W podniesionej temperaturze cząsteczki kwasu azotowego ulegają rozkładowi na rodniki:
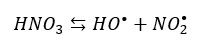
Nitrowanie alkanów przebiega więc według mechanizmu rodnikowego.
To jeszcze nie wszystko, ponieważ związki nitrowe możemy otrzymać w reakcji substytucji nukleofilowej. Klasycznej substytucji nukleofilowej. Chlorowcopochodne węglowodorów reagują z azotanami(III) i tworzą nitrozwiązki.
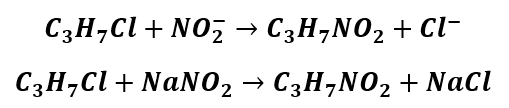
Tak, nitrowanie arenów jest reakcją redox. Ale wiele osób w pierwszej chwili odpowie, że to nie jest reakcja redox. To właśnie z tego powodu, że stopień utlenienia atomu azotu w grupie nitrowej wynosi III, związki litrowe można otrzymać w reakcji z azotanami(III). A czy reakcja chloroetanu z roztworem NaNO2 jest też reakcją redoks czy nie?
Rozpatrzmy jeszcze reakcję bromowania fenolu. W wodnym roztworze brom reaguje z fenolem tworząc 2,4,6-tribromofenol:

Jak zapisać równania połówkowe? Zacznijmy od redukcji…
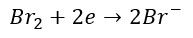
A co z równaniem utleniania? Możemy użyć części anionów bromkowych w tym równaniu, które wcześniej wygenerowaliśmy w równaniu redukcji.
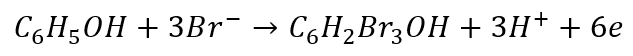
Po wymnożeniu równań połówkowych w celu zbilansowania elektronów i dodaniu otrzymujemy równanie sumaryczne:
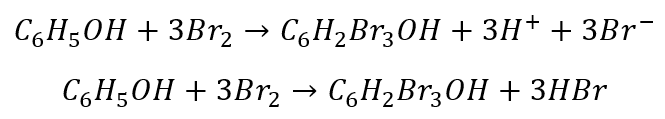
Taka praktyka jest często spotykana i w dalszej części spotkamy się z nią ponownie.
Ale najpierw pokażę, że dokonując takich operacji dokonujemy pewnego paradoksu. Zastanówmy się: skąd pochodzą elektrony w równaniu redukcji? „Wyciągamy” je z cząsteczki fenolu. Ale w równaniu utleniania pojawiają się aniony bromkowe – te, które wcześniej wygenerowaliśmy używając elektronów zabranych wcześniej od cząsteczki fenolu. Czyli wraz z tymi anionami bromkowymi do cząsteczki fenolu wracają wcześniej zabrane elektrony! Nie wszystkie co prawda, ale część zabranych „wkładamy” z powrotem. A ponieważ równania połówkowe to tylko matematyka, a nie rzeczywistość, to pomyślmy teraz razem. Pytanie: czy ma znaczenie czy ja najpierw zabiorę elektrony cząsteczce fenolu i przekażę je atomom bromu, a następnie użyję tych atomów bromu wzbogaconych w elektrony w równaniu utleniania i zwrócę część zabranych elektronów, czy też mogę w równaniu utleniania użyć obojętnych atomów bromu i po prostu zabrać mniej elektronów?
Czyli tak:
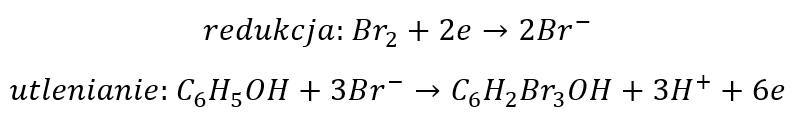
Czy tak:
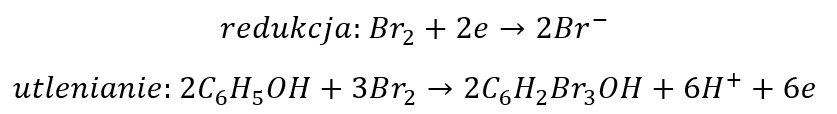
Czy to coś zmienia? Sprawdźmy. W pierwszym przypadku doszliśmy do takiego równania reakcji:
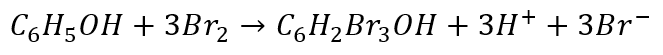
A co otrzymamy w 2 przypadku? Pomnóżmy i zsumujmy.
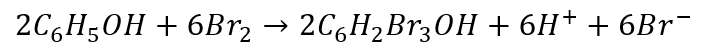
A w postaci najmniejszych liczb całkowitych:
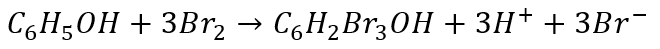
I to pomimo tego, że równania reakcji połówkowej utleniania się różnią, to dochodzimy do tego samego równania reakcji redoks. Dlaczego? Z tego samego powodu, o którym wspominałem wcześniej: równania połówkowe nie mówią nam nic o ścieżce reakcji. Służą tylko do bilansowania. To tylko matematyka - otrzymaliśmy równoważne układy równań połówkowych, więc muszą prowadzić do tego samego rozwiązania.
Taki zabieg z przenoszeniem anionów halogenkowych jest stosowany na przykład w reakcji haloformowej, jak w reakcji acetonu z jodem w środowisku zasadowym:
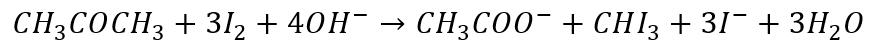
I równania połówkowe:
Redukcja:
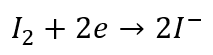
I utlenianie:
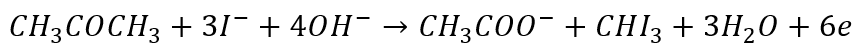
Jest to bardziej tradycyjna forma. Ale także tutaj Równania połówkowe to tylko matematyka. Możemy legitnie zapisać alternatywne równania reakcji połówkowych:
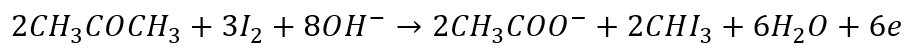
W reakcji jodoformowej utleniaczem wcale nie jest jod. A jednak zapisujemy go w równaniach połówkowych… Utleniaczem jest anion IO- powstający w wyniku dysproporcjonowania jodu w zasadowym środowisku:
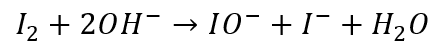
Gdy wrzucić jod do zasady to otrzymujemy bezbarwny roztwór. Właśnie wskutek reakcji dysproporcjonowania. Jeśli do tego roztworu dodać metyloketonu, to powstaje osad jodoformu, a przecież jodu, tradycyjnie zapisywanego jako substrat – w układzie nie było… A mechanizm reakcji jodoformowej jest znacznie bardziej skomplikowany… I jeśli prześledzimy, to w osobnym artykule poświęconym reakcji haloformowej, to sami zauważymy, że rzeczywista ścieżka reakcji nie ma nic wspólnego z tym, co zapisujemy w równaniach połówkowych…
Na koniec moja prośba do nauczycieli. Zarówno tych szkolnych, jak i akademickich: nie traktujmy równań reakcji połówkowych (elektrodowych) jak świętość. To jest tylko narzędzie do bilansowania. Nic za to nie mówi o ścieżce reakcji. Mówimy, że utleniamy alkohole dichromianem potasu w zakwaszonym środowisku. Ale jak się przyjrzymy bliżej, to wcale nie aniony dichromianowe działają utleniająco itd. Dichromianu potasu użyliśmy tylko by przygotować odczynnik utleniający. Bo każda reakcja ma jakiś swój mechanizm, a reakcje połówkowe (elektrodowe) o nim nic nie mówią. Nawet ta wymiana elektronów w wielu przypadkach fikcyjnym założeniem, ale o tym to napiszę już innym razem. I mam nadzieję, że niedługo. Jestem znowu w formie!
A! Jeszcze muszę wyjaśnić, dlaczego niektórzy nie potrafią zbilansować tej redukcji nitro benzenu. Ta trudność występuje tylko wtedy, gdy używać wsteczniczej metody za stopniami utlenienia. Niektórzy z góry błędnie zakładają, że stopień utlenienia azotu w nitrobenzenie jest równy V.

I dochodzą sprzeczności:
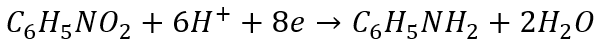
Bo przecież zgadzają się atomy, ale ładunek elektryczny nie zgadza się po obu stronach…A tymczasem w wyniku nitrowania azot obniżył swój stopień utlenienia z V na III…
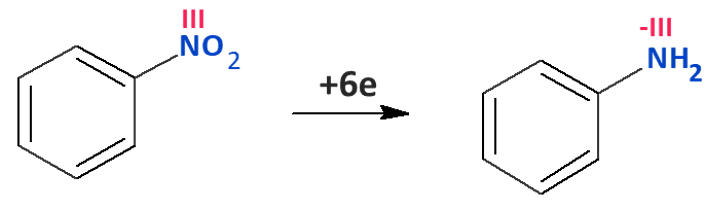
I teraz dopiero się zgodzi:
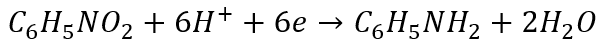
Ale problem mają tylko ci, którzy nie wiedzą, że to problem, którego nie ma, tylko problem stworzony przez samą edukację szkolną. Bo ci, którzy do bilansu jonowo-elektronowego podchodzą jak należy – tego problemu nie mają. Z bilansowania reakcji redoks w ogóle zrobiono potwora edukacyjnego: z prostej rzeczy zrobiono problem. A tak chyba być nie powinno. Po prostu pora skończyć z wstecznictwem i skupić się na tym, co ma być. Czyli na bilansie jonowo-elektronowym, w którym nie używa się stopniu utlenienia. A stworzenie potwora edukacyjnego polega na wsteczniczym stosowaniu stopni utlenienia i jednoczesnej próbie zastosowania ich do metody jonowo-elektronowej, która z natury ma ich nie używać. I tak metoda, która została wprowadzona po to, by ułatwić bilansowanie - w praktyce szkolnej skomplikowała prostą rzecz.
A przypominam, że stopnie utlenienia to jest pojęcie jeszcze bardziej fikcyjne, a przede wszystkim zazwyczaj niepotrzebne. Stopnie utlenienia nie istnieją. A skoro coś nie istnieje, to jaki jest sens nad nim gdybać: ile wynosi stopień utlenienia atomu X – no ile może wynosić coś, co nie istnieje? Przypisujemy je, ale ich nie ma, ponadto nawet obliczając wyimaginowane ładunki elektryczne - często są dyskusyjne, bo który atom powinien zabrałby elektrony? Przede wszystkim nie odnoszą się do rzeczywistości, a ponadto wynik zależy od skali elektroujemności. Prawie zawsze stosuje się Paulinga, której miejsce jest w lamusie, ale jak użyć innej skali, to atom, którego stopień utlenienia wyznaczamy na podstawie skali Paulinga może mieć zupełnie inny stopień utlenienia w tym samym związku, gdy użyć innej skali… Zobaczmy na definicję stopnia utlenienia: taki ładunek, jaki istniałby – no kurde! Jaki istniałby, a nie jaki jest! Ponadto, jak wspomniałem, często są trudne do ustalenia. Dlatego zrezygnowano ze stopni utlenienia przy bilansowaniu redoksów. Bo często są zawodne i nie zawsze pozwalają rozwiązać problem. A czy bilans reakcji w probówce zależy od stopni utlenienia? Jak bilans reakcji mógłby zależeć od czegoś, co nie istnieje? Więc nie zależy. Utrudniamy sobie (lub utrudniamy innym) życie czymś takim. Stosujemy metodę jonowo-elektronową, w której do zbilansowania równania reakcji redoks wystarczy wykonać bilans masy i bilans elektronowy. Albo raczej: stosujmy, bo z tym stosowaniem to jest w praktyce źle, a przeważnie: bardzo źle. A tak wiele osób nie jest w stanie ruszyć redoksa, jeśli najpierw nie ustali stopni utlenienia, albo nie jest w stanie ich ustalić. Bo nikt im powiedział, że w ogóle nie trzeba wiedzieć, co to jest stopień utlenienia, żeby zacząć bilansować reakcję redoks. Żeby określić, co się utlenia, a co redukuje. Tę kwestię wyjaśniam tutaj.
PS a jeszcze w kwestii stopni utlenienia. Można samemu się przekonać i policzyć elektrony: gdyby atom azotu miał V stopień utlenienia w nitrobenzenie, to nitrobenzen nie byłby związkiem, tylko kationem o ładunku 2+. A to oznacza, że występowałby tylko w solach, np. [C6H5NO2]SO4 albo [C6H5NO2]Cl2, a nie jako samodzielny związek.
PPS a jeszcze w kwestii mechanizmu reakcji jodoformowej – czy widzimy gdzieś etap, w którym byśmy wyciągali elektrony z cząsteczki acetonu i przekazywali je atomom jodu? Niby tak, ale przyjrzyjmy się – czy atom jodu rzeczywiście na tym zyskuje elektrony, a cząsteczka organiczna traci? Ale tę kwestię szerzej omówimy następnym razem.