Artykuł ten został opublikowany także w numerze 1/2018 "Chemii w szkole"

Próba Trommera chyba na stałe znalazła się w kanonie edukacyjnym. Jednakże warto ją wziąć pod lupę i przyjrzeć się, czemu ona w rzeczywistości służy, jak się ją przeprowadza i dlaczego. A dlaczego ją biorę pod lupę? Myślę, że w następnych zdaniach szybko się o tym przekonamy. Uczymy się w szkole średniej, że jest to próba pozwalająca odróżnić aldehydy od ketonów, ale także aldehydy od szeregu innych związków, które albo tej próbie nie ulegają, albo reagują inaczej z odczynnikiem Trommera.
UWAGA: wszystkie podane w artykule informacje zostały sprawdzone wcześniej doświadczalnie w Centrum Badań Molekularnych i Makromolekularnych PAN w Łodzi.
O samym odkrywcy próby, Carlu Auguście Trommerze wspomina się niewiele – ot, urodzony w 1806 roku niemiecki chemik, weterynarz i farmaceuta, jeden z pionierów badania moczu. Zmarł w 1879. To on w 1841 opublikował pracę, w której zaproponował metodę na ocenianie zawartości glukozy w moczu. Metoda ta opierała się na redukcji wodorotlenku miedzi(II) do ceglastego osadu tlenku miedzi(I) w obecności glukozy w moczu. Szybko doczekała się dziesiątek, by nie powiedzieć – setek modyfikacji. Z czasem więc do powszechnego zastosowania weszły dwie inne metody: próba Benedicta i próba Fehlinga i już w dwudziestoleciu międzywojennym nauka o próbie Trommera stała się bardziej edukacyjną tradycją, niż wykonywany w praktycznych badaniach laboratoryjnych rzeczywistym testem. Nawet chyba mogę pokusić się o stwierdzenie, że to lokalna tradycja, bo rzeczywiście próżno jej szukać w wielu zagranicznych akademickich książkach. Po prostu jej modyfikacje okazały się w praktyce lepsze i bardziej czułe i naturalną koleją rzeczy – wyparły ją, niemal tak, jak kwas solny wypiera siarkowodór skutecznie z jego soli.
Reakcja charakterystyczna i jej objawy
Zanim przejdziemy dalej zastanówmy się: czym właściwie jest i czym się charakteryzuje reakcja charakterystyczna? Tak, napisałem celowo w ten sposób poprzednie zdanie. Reakcję charakterystyczną wyróżnią fakt, że daje konkretną, jednoznaczną obserwację, którą można odczytać w sposób pozwalający stwierdzić, że reakcja zachodzi lub nie zachodzi. Żeby to jednak było możliwe, to każdą taką reakcję przeprowadza się wobec konkretnych warunków. W przypadku omawianej próby obserwacją tą jest strącenie się osadu tlenku miedzi(I) Cu2O. Nawet Trommer musiał umieć oszacować zawartość cukru w moczu na podstawie jej wyniku. Tak więc musiał stosować określone stężenia odczynników i ich ilości, odmierzać określone ilości moczu oraz trzymać się określonego toku postępowania. Ponieważ wygląd probówki po reakcji zależał od ilości zredukowanego Cu(OH)2, to na podstawie: ilości i wyglądu osadu Cu2O był on w stanie oszacować ilość cukru. Oczywiście takie postępowanie wymaga wykonania wzorców – prób z użyciem różnych, ale dokładnie określonych ilości cukru, bo wtedy porównując wynik badania z odpowiednim wzorcem można oszacować zawartość cukru w moczu. Próba ta jednak weszła do kanonu edukacji nie ze względu na możliwość badania moczu, ale ze względu na możliwość identyfikacji aldehydów i ich odróżniania od innych związków. Aldozy także zaliczamy do aldehydów.
Podczas wykonywania próby najpierw nadmiarem mocnej zasady strącamy galaretowaty osad Cu(OH)2, który nie jest trwały i rozkłada się nawet w temperaturze pokojowej, z tego też powodu nie nadaje się do dłuższego przechowywania. Z tego też powodu związek ten otrzymujemy bezpośrednio przed przeprowadzeniem próby. Rozkład następuje szybko w podniesionej temperaturze i wskutek rozkładu otrzymujemy czarny osad CuO:
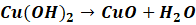
Zatem najpierw strącamy galaretowany wodorotlenek nadmiarem zasady. Następnie do alkalicznej zawiesiny dodajemy badany związek i wstrząsamy probówka celem wymieszania jej zawartości. Jeśli badany związek nie tworzy w tych warunkach związku kompleksowego, to początkowo nie dzieje się nic szczególnego – widzimy zawiesinę Cu(OH)2. Następnie wstawiamy probówkę do gorącej łaźni wodnej. Tak zazwyczaj wygląda początek reakcji:
Pojawienie się osadu barwy początkowo żółtej, ale przechodzącego w ceglastą oznacza pozytywny wynik próby – nasz związek to prawdopodobnie aldehyd. Pojawienie się czarnego osadu oznacza negatywny wynik próby Trommera, gdy badany związek nie spowodował redukcji zawiesiny Cu(OH)2, a jedynie wodorotlenek ten rozłożył się pod wpływem, podniesionej temperatury. Nie jest to jednak jedyna obserwacja świadcząca o negatywnym wyniku próby, co za moment sobie też wyjaśnimy.
Jednakże aldehydy to nie tylko proste pochodne alkanów. To także związki wielofunkcyjne. Związki z ugrupowaniem 1,2-diolowym, gdzie należą liczne alkohole polihydroksylowe, jak glikol etylenowy (etandiol) i glicerol (1,2,3-propantriol), oraz cukry (które jako związki wielofunkcyjne są zarówno alkoholami polihydroksylowymi jak i związkami karbonylowymi – aldehydami i ketonami) reagują z osadem dając roztwory o intensywnej barwie: glikol i glicerol dają mocny szafirowy kolor, glukoza i fruktoza fioletowoszafirowy, a z kolei sacharoza – granatowy. Fotografia poniżej przedstawia osad wodorotlenku miedzi (z prawej), oraz kompleks tego wodorotlenku z glukozą (z lewej).

Drugą możliwością jest więc roztworzenia osadu Cu(OH)2 i utworzenie roztworu związku kompleksowego. W przypadku 1,2-dioli nieulegających próbie Trommera (jak gliceryna czy sacharoza) kompleks ten jest trwały w temperaturach łaźni wodnej, dlatego w tym przypadku jako wynik negatywny – nie zaobserwujemy żadnych zmian! Ani tym bardziej czarnego osadu! Tę sytuację także możemy zobaczyć: po lewej wynik pozytywny (zarówno dla osadu Cu(OH)2 jak i roztworu kompleksu) oraz negatywny (po prawej kompleks z sacharozą):
Tak więc są trzy możliwości: czarny osad oraz szafirowy roztwór – jako wynik negatywny, a ceglasty lub ewentualnie żółty osad – jako pozytywny.
Co ulega próbie Trommera?
Aldehydy:
Jak wiemy, aldehydy utleniają się łatwo, tak więc nawet łagodne utleniacze powodują zwiększenie stopnia utlenienia węgla karbonylowego. Jednakże czy każdy z nich ulega próbie? Rozpatrzymy kilka przypadków pospolitych aldehydów.
-aldehyd mrówkowy: używany jest niemal wyłącznie w postaci formaliny. Ze względu na brak ugrupowania alkilowego w łańcuchu ma najsilniejsze właściwości redukujące ze wszystkich aldehydów. W wyniku próby Trommera często produktem ciemnobrunatna metaliczna miedź przy odpowiedniej dużej ilości aldehydu, lub przy mniejszej ilości mieszanina miedzi z ceglastym Cu2O. Zdarza się także delikatne lustro miedziane.
-aldehydy dobrze rozpuszczalne w wodzie (jak octowy, glutarowy): ulegają próbie, dają klasyczny wynik w postaci ceglastego osadu.
-aldehyd benzoesowy: jest praktycznie nierozpuszczalny w wodzie, nie ulega próbie ze względu na brak odpowiedniej rozpuszczalności w środowisku reakcji. Aldehydy praktycznie nierozpuszczalne w wodzie nie ulegają próbie.
-aldehyd salicylowy: posiada grupę hydroksylową, tworzącą silne wiązanie wodorowe wewnątrzcząsteczkowe. To wiązanie aktywuje grupę karbonylową aldehydu. W środowisku silnie zasadowym ulega błyskawicznej reakcji Cannizzaro, dając alkohol salicylowy oraz sól kwasu salicylowego. Powoduje to, że nie ulega próbie, tylko daje dobrze rozpuszczalny salicylan miedzi o barwie zielonej. Objawem jest więc roztwarzanie osadu Cu(OH)2 i powstanie zielonego r-ru, z którego można otrzymać dość efektowne kryształy.
-cukry redukujące: tworzą rozpuszczalne w wodzie kompleksy z miedzią(II), o intensywnej barwie. Do cukrów redukujących mogą należeć zarówno aldozy, jak i ketozy. Mogą to być zarówno cukry proste jak i disacharydy i oligosacharydy. Warunkiem, aby cukier zaliczał się do redukujących jest możliwość otwarcia pierścienia w wodnym roztworze. Ketozy, takie jak fruktoza, w silnie zasadowym środowisku prowadzenia tej próby ulegają epimeryzacji do aldoz, przez co dają także wynik pozytywny. Do cukrów redukujących nie należy sacharoza.
Inne reduktory:
-hydroksyloamina NH2OH: to jeden z ciekawszych reduktorów. Ulega próbie dając klasyczne objawy. Na naszym kanale You Tube dostępny jest film z redukcją kwasu azotowego do hydroksyloaminy oraz jej próba Trommera.
-witamina C (kwas L-askorbinowy): choć nie posiada ugrupowania aldehydowego jest dość silnym reduktorem. Ze względu na to, że jest kwasem przechodzi najpierw w zasadowym środowisku w sól – askorbinian. Dopiero askorbinian ulega próbie. W przypadku niedostatecznej ilości mocnej zasady powoduje roztwarzanie Cu(OH)2 i powstanie niebieskiego roztworu askorbinianu miedzi. Nadmiar witaminy C daje zielonożółte roztwory kompleksów miedzi.
-kwas mrówkowy: temu przypadkowi chcę poświęcić szczególną uwagę, bo z jego powodu głównie powstał ów artykuł. Powszechnie o tym kwasie krążą opinie, że kwas ten ulega próbie Tollensa i Trommera, jako że posiada ugrupowanie aldehydowe. Tymczasem kwas ten, a właściwie jego sole: mrówczany, nie tylko co nie dają lustra srebrnego, tylko co najwyżej osad metalicznego srebra, co i NIE ulega próbie Trommera. Kwas mrówkowy jest bowiem trudniej utlenić niż formaldehyd. Kwas mrówkowy daje wynik negatywny: czarny osad CuO. Nie musimy już chyba tłumaczyć, że w warunkach próby konieczne jest zasadowe środowisko – kwas musi przejść w anion mrówczanowy. Dodając kwasu mrówkowego do zawiesiny Cu(OH)2 przy braku nadmiaru zasady po prostu roztworzymy ten wodorotlenek i otrzymamy sól – mrówczan miedzi(II). Przy nadmiarze zasady powodujemy przejście kwasu w mrówczan sodu lub potasu, ale nie roztwarzamy Cu(OH)2 – w tych warunkach po wstawieniu probówki z zawiesiną w r-rze mrówczanu sodu czy potasu, to mimo zasadowego środowiska otrzymamy wynik negatywny: czarny osad.
-glicerol: jako alkohol nie ulega próbie Trommera. Celowo jednak o nim tutaj wspominam – próbę prowadzimy w gorącej łaźni wodnej, a więc w ok. 90 oC. W tych warunkach szafirowy kompleks jest stabilny i daje wynik negatywny. Jednakże czy pamitamy, że CuO utlenia pary alkoholi w wysokich temperaturach? Jeśli pogrzać do ok. 150 oC szafirowy roztwór kompleksu, a więc zdecydowanie wyżej, niż wymaga próba Trommera, to zaczyna się reakcja redoks, w której strąca się ceglasty osad Cu2O, a glicerol utlenia się do aldehydu glicerynowego oraz dihydroksyacetonu.
Nieprawdziwe i prawdziwe stwierdzenia dotyczące próby
Tytuł tego artykułu nie jest przypadkowy. Próba Trommera to prawdopodobnie najbardziej otoczona herezjami reakcja z kanonu edukacyjnego. Powszechną i błędną opinią jest stwierdzenie, że próba Trommera to reakcja ze świeżo strąconym wodorotlenkiem miedzi i taki zapis spotykamy często w schematach reakcji. Nic bardziej mylnego! Nie ma próby Trommera bez silnie zasadowego środowiska – nadmiaru zasady w stosunku do stechiometrycznej ilości CuSO4. To jest reakcja z Cu(OH)2, jak zwykło się mówić, ale reakcja z Cu(OH)2 i mocną zasadą. Winę za część niepowodzeń ponosi nie jakość czy wiek odczynników, co po prostu brak odpowiedniego środowiska reakcji. Zapiszmy równanie ogólne dla tej reakcji:
Produktem nie może być i nie jest kwas karboksylowy, tylko jego sól. Na kilku filmach edukacyjnych pokazuję, że reakcja ta nie zachodzi bez nadmiaru zasady. Drugim pospolitym, ale błędnym stwierdzeniem jest to, że można w jej wyniku otrzymać kwasy karboksylowe – nie można, z powodu, który już wyjaśniliśmy. Kwas można dopiero wydzielić z jego soli wypierając go mocnym kwasem, a więc w kolejnej reakcji, która z tytułową próbą nic wspólnego.
Zapomnijmy więc o takim zapisie:
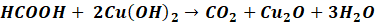
Ale o tym też zapominamy:
Wodorotlenki drugiej grupy
Czy do przeprowadzenia próby potrzebujemy koniecznie bardzo dobrze rozpuszczalnego wodorotlenku z pierwszej grupy układu okresowego? Okazuje się, że niekoniecznie. Dobre wyniki osiągniemy stosując Ba(OH)2, który jest jednym z kilku dobrze rozpuszczlanych wodorotlenków. Oczywiście musimy się liczyć z tym, że stosując roztwór CuSO4, w reakcji z r-rem Ba(OH)2 strącą się dwa osady:
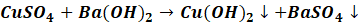
Związki miedzi i srebra jako utleniacze
Biorę pod uwagę, że nie dla każdego czytelnika będzie jasny ten akapit, ale dla tych, którym jest znane pojęcie potencjału redukcji sprawa będzie łatwiejsza w przyswojeniu jej sobie. Związki srebra są silniejszymi utleniaczami niż związki miedzi (potencjał standardowy redukcji srebra w kompleksie [Ag(NH3)2]+ wynosi 0,37 V, a redukcji Cu(OH)2 do Cu2O tylko -0,08 V). Tak więc związki srebra utleniają większy zbiór związków niż związki miedzi, bo mają siłę utlenić to, czego związku miedzi już nie mogą. Pamiętajmy, że nie możemy się w tym przypadku posłużyć potencjami standardowymi w szkolnej wersji, a to z tego powodu, że tam uwzględnia się potencjały dla stężenia wolnych jonów w roztworze równego 1 mol/dm3 – a my posługujemy się nie r-rem CuSO4, czy AgNO3, tylko osadem Cu(OH)2 i częściowo kompleksem [Cu(OH)4]2- oraz kompleksem [Ag(NH3)2]+, w których stężenie wolnych jonów Cu2+ i Ag+ jest zaniedbywalnie małe, a potencjał redukcji znacznie niższy niż w przypadku r-rów jednomolowych (+0,34 V dla Cu2+ i +0,80 V dla Ag+). Stężenie wolnych jonów w naszym przypadku jest tylko stężeniem równowagowym, bo dominują formy związane, a nie wolne kationy metali. Potencjał z kolei zależy od stężenia wolnych jonów, co wyraża równanie Nernsta i maleje ze spadkiem stężenia. Tak więc potencjał w naszym przypadku jest niższy, a nie dość tego, bo jeszcze nie redukujemy Cu(II) do Cu, tylko do Cu2O. A to duża różnica. O tym, że związki srebra są silniejszymi utleniaczami można się przekonać w dość szczególny sposób. Wystarczy dodać trochę tlenku miedzi(I) do amoniakalnego roztworu tlenku srebra Ag2O, używanego w próbie Tollensa. Roztwór ten w istocie zawiera kompleks diaminasrebra. Ponieważ ma on wyższy potencjał redukcji, Cu2O może być przez niego utleniony. Co więc się stanie, jeśli dodaliśmy zawiesinę Cu2O do odczynnika Tollensa? Otrzymamy srebro w postaci osadu, a nawet możliwe jest częściowe utworzenie lustra srebrnego, zaś bezbarwny roztwór przyjmuje szafirowe zabarwienie. Tak więc Cu2O ulega próbie Tollensa. Dodatkowy wniosek z tego to taki, że cukry redukujące to takie cukry, które utlenić bardzo łatwo. bowiem musimy sobie zdawać sprawę też z tego, że silne utleniacze jak KMnO4 - utlenią każdy cukier, (nawet do CO2) i to, czy cukier ten daje pozytywny wynik próby, nie ma znaczenia. I zapamiętajmy - aldehydy utleniają się łatwo, ale kwas mrówkowy jest zdecydowanie trudniej utlenić, niż aldehyd mrówkowy. Z tego powodu kwas mrówkowy, a właściwie jego sole mrówczany potrzebują silniejszego utleniacza niż Cu(OH)2, a może nim być kompleks diaminosrebra.
Zakończenie
Pokazałem, że o próbie krążą nieprawdziwe informacje, oraz że ulegają jej także inne związki. Być może Carl August Trommer nieraz by się obrócił w grobie widząc, że odkryta przezeń reakcja jest w takim stopniu otoczona nieprawdziwymi osądami. Artykuł ten posłuży nam także dalej, gdyż nawiążemy do niego w najbliższym numerze czasopisma Antocyjan, kontynuując temat niedorzeczności w zbiorach zadań z chemii.