Kontynuuję temat błędów spotykanych z zadaniach ze zbiorów szkolnych, choć problem dotyczy też w jakimś stopniu szkolnictwa wyższego. Poprzednio celem były zadania obliczeniowe, w których nie miały miejsca reakcje chemiczne, ale tym razem przyjrzymy się zadaniom, w których pojawiają się takowe. Przypominam też, że pojedynczy błąd traktuję jako zwykłe niedopatrzenie, ale gdy ten sam błąd pojawia się kilka razy w jednym zbiorze, albo w kilku zbiorach, to znaczy, że warto na niego zwrócić uwagę.
1. Związki wapnia i ich stężenie w roztworze
Wapń to chyba jeden z ulubionych pierwiastków wielu autorów. Sam zresztą układam zadania nieraz posługując się związkami wapnia. Ale rozpatrzmy na początek takie polecenie zadania:
„Do 20 g wody wrzucono 1 g sodu. Oblicz stężenie otrzymanego roztworu.”
Tego typu zadania przewijają się przez fora czy grupy dyskusyjne. Przy rozwiązywaniu zadania należy uwzględnić, że przecież sód reaguje z wodą i otrzymujemy roztwór NaOH:
2Na + 2H2O → 2NaOH + H2
Uwzględniamy, że nasza masa substancji to 1,74 g NaOH, zaś masa roztworu to 21 g pomniejszone o 0,04 g wodoru wydzielonego w tej reakcji. Otrzymamy więc stężenie 8,3%. W rzeczywistości może być ono nieznacznie wyższe, bo ciepło reakcji spowoduje odparowanie niewielkiej ilości wody. Generalnie sposób postępowania jest w pełni akceptowalny.
Spójrzmy jednak na polecenie poniżej:
„Do 50 g wody wrzucono 4 g wapnia. Oblicz stężenie procentowe otrzymanego roztworu”
Powtarzając obliczenia z uwzględnieniem równania reakcji:
Ca + 2H2O → Ca(OH)2 + H2
Otrzymamy 7,4 g Ca(OH)2, wydzieli się 0,2 g H2, zatem otrzymamy masę układu 53,8 g. Odpowiedź do zadania to 14%. Ale czy otrzymaliśmy w rzeczywistości 14%? Niestety nie, bowiem otrzymamy ok. 0,17%. Wynika to stąd, że wodorotlenek wapnia jest w wodzie dość trudno rozpuszczalny: 0,17 g/100 g H2O w 20 °C . Po prostu nadmiar Ca(OH)2 utworzy zawiesinę (mleko wapienne) lub osad na dnie po jakimś czasie. Otrzymany wynik pierwotnych obliczeń, czyli 14%, to udział masowy Ca(OH)2 w układzie poreakcyjnym, ale nie stężenie, bo ono wynosi 0,17%. Nie oszukamy natury – otrzymamy zawiesinę Ca(OH)2 w jego nasyconym roztworze. Dodajmy, że niezbyt stężonym.
Przyjrzyjmy się poleceniom do zadań:
„Do naczynia zawierającego 36g wody wrzucono 4g wapnia. Oblicz stężenie procentowe otrzymanej wody wapiennej.”
„Aby otrzymać wodorotlenek wapnia uczniowie umieścili 20 g metalicznego wapnia w kolbie, a następnie zalali je 500 cm3 wody destylowanej. Obserwowali tworzenie się pęcherzyków gazu i roztwarzanie się wapnia.”
Oczywiście w żadnym z tych zadań nie uwzględniono, że otrzymuje się zawiesinę. W tym ostatnim przypadku dodatkowo popełniono błąd podając masę molową Ca(OH)2 jako 76 g/mol oraz 4 propozycje obliczeń i należy wybrać prawidłowy zestaw – niestety, żadne z nich nie jest prawidłowe, ale nie tylko przez to, że otrzymujemy osad, ale też przez błąd w wyznaczaniu objętości roztworu we wszystkich podanych przypadkach. Zadań gdzie wodorotlenek wapnia nagle stał się bardzo dobrze rozpuszczalny w wodzie natomiast – znajdziemy całkiem sporo, ale nie ma sensu przytaczać tutaj więcej takich przykładów. Zmiana właściwości nie dotyczy tylko wodorotlenku wapnia, ale także innych związków, które na potrzeby zadania stają się nagle dobrze rozpuszczalne – a przecież niektórzy uczniowie widzą w tabeli rozpuszczalności, że coś nie pasuje i potem zadają pytania na forach czy na grupach dyskusyjnych, a w niektórych przypadkach szukają uzasadnienia tego fenomenu, że wg tabeli rozpuszczalności dany związek jest trudnorozpuszczlany, a „w rzeczywistości” da się go rozpuścić, bo przecież zadanie takie liczyli. A nie zdają sobie sprawy z tego, że to fantazja poniosła autora zadania.
2. Próba Trommera
W ostatnich tygodniach celowo napisałem artykuł o próbie Trommera, gdyż reakcja ta najpierw wymagała obszernego komentarza. Artykuł ten powstał głównie z powodu kwasu mrówkowego, a można go przeczytać tutaj i serdecznie zapraszam do jego lektury przed przeczytaniem tego akapitu. Pierwszym nieprawdziwym stwierdzeniem jest, że w próbie Trommera powstają kwasy, zamiast sole. Skupimy się na przypadku kwasu mrówkowego. Mimo, że zdajemy sobie sprawę z tego, że kwas w reakcji z wodorotlenkiem da przede wszystkim sól, to jednak co rusz w przypadku kwasu mrówkowego spotykamy polecenia, w których należy opisać objawy reakcji, które nie mają miejsca, np. na pewnym próbnym arkuszu maturalnym pojawiło się zadanie oceniane w ten sposób:

Tymczasem po lekturze artykułu wiemy, że takie rzeczy nie mają miejsca, więc ani ceglasty osad, ani wydzielający się gaz. Zobaczmy na inne zadanie:
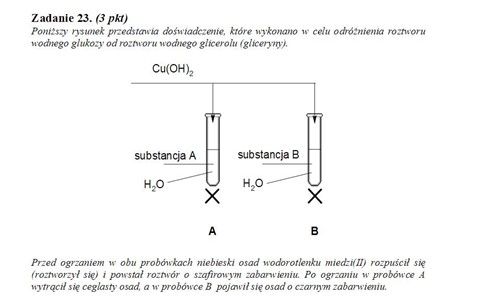
W probówce B czarny osad nie powstaje, bo kompleks glicerolu jest trwały w warunkach przeprowadzania próby Trommera – gorącej łaźni wodnej. Po raz kolejny prawidłowa odpowiedź podaje objawy, które nie mają miejsca podczas wykonywania doświadczenia. Przykłady takie można mnożyć i myślę, że niejeden czytelnik natrafił na podobne zadanie.
3. Określanie składu mieszanin na podstawie reakcji chemicznej
Na forach oraz grupach maturalnych lubią się pojawiać zadania z określeniem składu mieszaniny na podstawie reakcji chemicznej. Często sprawiają one problemy uczniom, a chyba najczęściej są to zadania ze stopami metali, choć oczywiście polecenia bywają rozmaite. Przyjrzyjmy się jednak poleceniu zadania:
„Mieszaninę etanolu i acetonu o łącznej masie 10 g poddano reakcji z nadmiarem sodu, w wyniku czego otrzymano 974 cm3 odmierzonego w warunkach normalnych. Oblicz procentową zawartość wagową acetonu w mieszaninie.”
Zastanówmy się, jak byśmy to rozwiązali? Zapewne sód reaguje z etanolem wypierając z niego wodór. Wynik podany przez autora także sugeruje to założenie. Czy jednak aceton jest wobec sodu obojętny? Niestety, bo choć lubimy o tym zapominać, to ketony są słabymi kwasami, o kwasowości porównywalnej do alkoholi. Tak więc sód roztwarza się w acetonie i to całkiem intensywnie, a jeśli ktoś nie wierzy, niech sobie sprawdzi. Dlatego też nie suszy się ketonów nad sodem, ani nie przechowuje ich nad nim. Produktem reakcji sodu z acetonem jest sól – związek jonowy:
2CH3COCH3 + 2Na → 2CH3C(ONa)=CH2 + H2
Warto tutaj wspomnieć, że 1,3-diony, związki z grupowaniem CO-CH2-CO, są już na tyle silnymi kwasami, że można wydzielić ich sole sodowe w postaci hydratów, sól sodową acetyloacetonu (1,3-pentanodionu) można kupić w postaci monohydratu. Wracając do naszego zadania: autor nie uwzględnił reakcji ketonu z sodem. W szkole średniej czy nawet na studiach gdy wspomina się o równowadze keto-enolowej, to rzadko się wspomina o tym, że ketony reagują z metalami aktywnymi, bo są słabymi kwasami, właśnie przez tę równowagę. A przecież można wybrać nieco szczęśliwszy przykład, zamiast acetonu coś co nie ma właściwości kwasowych, a zadanie miałoby większy sens. Łatwo wpaść w pułapkę, gdy zapomnieć, że kwasem jest nie tylko to, czego nazwa od słowa „kwas” się zaczyna. Ot, witamina C nie ma typowo kwasowej grupy, jak COOH, a jest na tyle silnym kwasem, że ma kwaśny smak i wypiera dwutlenek węgla z węglanów. Reakcja ketonów z metalami wymaga szerszego komentarza, więc będzie tematem osobnego artykułu.
PS dzień przed umieszczeniem tego artykułu na stronie (22.02.24) znalazłem takie zadanie na jednej z grup:
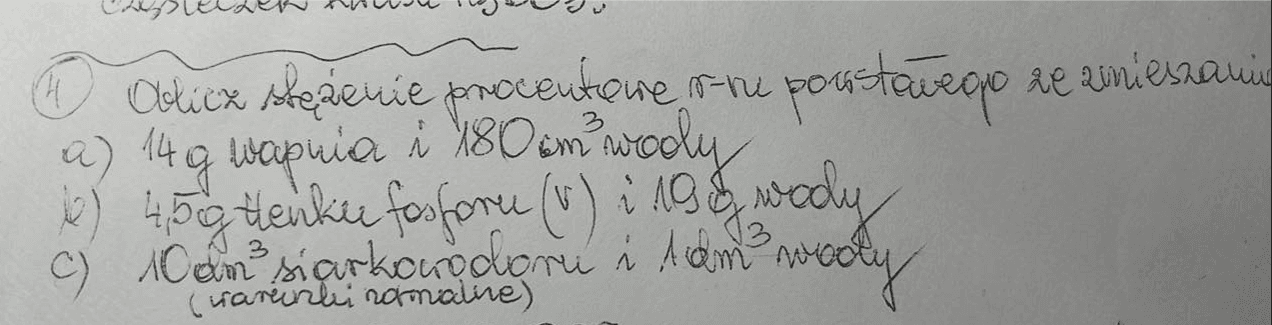
I tak się zastanawiam - dlaczego to zawsze jest wapń?