Zanim przejdziemy do głównego tematu, rozpatrzymy te nieuznaną odpowiedź z matury z chemii w 2022 roku. Zadanie było proste, poniżej widzimy informację wstępną do niego.
Mnie jednak zainteresowała jedna z odpowiedzi na polecenie, udzielona przez część osób zdających:

Odpowiedź ta brzmi: „przekracza to wartość rozpuszczalności => wytrąci się osad”.
Mnie jednak zainteresowało, dlaczego część osób tak napisała? I chyba znam przyczynę. Bo jedno z pojęć uczone jest błędnie i w sprzeczności z innymi pojęciami wdrażanymi w edukacji wcześniej.
Skoro rozpuszczalność KClO3 w 100 g wody w temperaturze 20°C wynosi 7 g, to gdy do 100 g wody sypać 7 g tej soli i zamieszać, to cała sól ulegnie rozpuszczeniu, a roztwór będzie nasycony. Nic się tutaj nie wytrąci. Gdybyśmy wsypali więcej niż 7 g, to rozpuści się tylko 7, a pozostała ilość pozostanie na dnie. Otrzymamy roztwór nasycony w równowadze z nierozpuszczonym nadmiarem soli. Nic się nie wytrąci - po prostu rozpuści się mniej, niż wsypaliśmy.
Przejrzyjmy się jeszcze temu zadaniu w maja 2015:

Jeśli dosypiemy do roztworu odpowiednią ilość KCl i podgrzejemy do 40 °C, to cały dodany chlorek się rozpuści, a roztwór będzie nasycony. Po prostu musi zachowana być proporcja, że na 100 g rozpuszczalnika będzie przypadać 40,2 g KCl.
Nic się tutaj nie wytrąci/nie wykrystalizuje. Aby doszło do wytrącenia/krystalizacji, roztwór musi być przesycony. Zauważmy, że w 20 °C na 100 g rozpuszczalnika może przypadać maksymalnie 34,2 g KCl. Gdyby więc ochłodzić roztwór z 40 do 20 °C, to cały dodany wcześniej KCl wykrystalizuje, bo po obniżeniu temperatury roztwór jest przesycony. Nadmiar substancji rozpuszczonej opuszcza więc roztwór.
No właśnie. Gdyby roztwór był przesycony, to nadmiar substancji opuściłby roztwór. I nie ma tutaj dla nas nic zaskakującego chyba. W końcu to rozpuszczalność. A ja jednak twierdzę, że osoba, która udzieliła tej nieuznanej odpowiedzi, została wprowadzona w błąd prawdopodobnie przez podręcznik albo i przez nauczyciela. A być może przez jeszcze kogoś/coś. I nie jest to jedyna wprowadzana w błąd osoba. W edukacji często bowiem brakuje konsekwencji, a dwa: pewne rzeczy są powtarzane bezrefleksyjnie. Skąd taka odpowiedź na to zadanie? Bo tak prawdopodobnie autorka tej odpowiedzi została nauczona przy innym dziale.
Zanim przejdę dalej, to rozpatrzmy sobie ten nasycony w temperaturze 20 °C roztwór KClO3 w wodzie. Na 100 g wody musi przypadać 7 g KClO3. Można go otrzymać w ten sposób, że do 100 g wody wsypię 7 g tej soli i zamieszam utrzymując temperaturę 20 °C. Jeśli wsypię więcej na przykład 10 g, to rozpuści się 7. A 3 g pozostaną na dnie. Nic się tutaj nie wytrąci, po prostu na dnie pozostaną 3 g nierozpuszczonej substancji.
Ale mogę nasycony roztwór tego związku przygotować inaczej. Zauważmy, że 7 g KClO3 to 2,23 g jonów K+ i 4,77 g jonów ClO3-. W 5,77 g KNO3 zawarte jest 2,23 g jonów K+, a 6,09 g NaClO3 zawarte jest 4,77 g anionów ClO3-. Jeśli więc w 100 g wody rozpuścić 5,77 g KNO3 i 6,09 g NaClO3 to masa wprowadzonych jonów K+ i ClO3- odpowiada 7 g KClO3 – a wiec roztwór jest nasycony względem KClO3. Ponadto masa jonów sodowych i azotanowych odpowiada 4,86 g NaNO3. A zatem roztwór o tym samym składzie można by otrzymać rozpuszczając 7 g KClO3 i 4,86 g NaNO3. Ale nie ma znaczenia, w jaki sposób ten roztwór został otrzymany. Ważne, że jest nasycony wobec KClO3. Czy w tym roztworze coś się wytrąci? Nie, bo nie ma z czego. Roztwór zawiera tyle kClO3 ile może zawierać. Aby doszło do krystalizacji KClO3, to roztwór musiałby być przesycony względem KClO3. A nie jest – jest tylko nasycony.
Ale rozpuszczalność substancji możemy charakteryzować także przez tzw. iloczyn rozpuszczalności. Rządzą tutaj te same zasady, bo przecież to ciągle są roztwory, inny jest tylko sposób wyrażania stanu równowagi.
Rozpatrzmy chlorek srebra wprowadzony do czystej wody w temperaturze 25 °C. Woda będzie się nim nasycać do momentu, aż stężenie tego związku wyniesie 1,33·10-5 mol/dm3. Lub też wartość tego stężenia podniesiona do kwadratu osiągnie 1,77·10-10, czyli osiągnie wartość iloczynu rozpuszczalności Kso. Rozpuszczalność związków jonowych zależy od stężeń obu jonów, stąd też roztwór jest nasycony względem AgCl wtedy, gdy iloczyn stężeń obu jonów wyniesie 1,77·10-10. Stężenia tych jonów nie muszą być sobie równe jak przy rozpuszczaniu AgCl w czystej wodzie – wystarczy, że iloczyn stężeń osiąga wartość Kso – wtedy otrzymujemy roztwór nasycony, a gdy iloczyn ten przekroczy wartość Kso – przesycony.
A teraz przyjrzyjmy się temu zadaniu ze słynnej próbnej matury z grudnia 2022 r.

A mnie interesuje bardzo jego rozwiązanie „z klucza”:

A teraz zobaczmy na podobne zadanie z próbnej matury z UJ z 01.04.2023:

I znowuż zobaczmy na odpowiedź:

Zwróćmy jednak uwagę na sprzeczność między tymi rozwiązaniami. I tak, w próbnym arkuszu CKE według odpowiedzi osiągnięcie iloczynu stężeń równego Kso pozwala osiągnąć zaobserwowany efekt wytrącenia PbI2. Z kolei po 3,5 miesiąca później maturzyści dowiadują się, że osiągnięcie wartości równej Kso NIE pozwala na strącenie osadu. A przecież obydwa rozwiazania bazują na osiągnięciu wartosci Kso! Ale wg jednego osiągnięcie tej wartosci nie prowadzi do wytrącenia osadu, a wg drugiego jest to wystarczające, by do tego wytrącenia doszło. A przecież nie może tak być tak, że osiągnięcie wartości Kso pozwala wytrącić i nie wytrącić osadu! Tylko jedna odpowiedź jest prawidłowa!
Podejście takie jak w prezentowanym zadaniu z CKE to typowe podejście szkolne: jeśli osiągamy wartość Kso, to strąca się osad. I na takie zadania często napotykam i widuję do nich właśnie takie odpowiedzi. Ale rację tutaj mają akurat Autorzy arkusza z UJ. Osiągnięcie wartości Kso przez iloczyn stężeń jonów prowadzi do osiągnięcie nasycenia roztworu. A to oznacza, że nic się nie wytrąci, bo nie ma z czego, skoro roztwór jest nasycony, a nie przesycony! Dopóki posługujemy się tylko rozpuszczalnością, to jest to jakoś oczywiste. Ale gdy przychodzi iloczyn rozpuszczalności, to nagle wiele osób prezentuje postawę, że strąci się osad, jeśli osiągnięta zostanie wartość Kso, czyli nasycenie roztworu... NIE. Przecież to ciągle to samo, tylko dodatkowe pojęcie się pojawiło. Prawidłowa odpowiedź na zadanie 10 z próbnej matury CKE to:
Minimalne stężenie molowe soli (NaI): powyżej 2,86·10-3 mol·dm-3.
Tak, stężenie musi być wyższe, bo aby doszło do jakiegokolwiek strącenia, to roztwór musi być przesycony, a nie nasycony! Pomyślmy przez chwilę logicznie: gdyby cokolwiek miało się wytrącić z roztworu po osiągnięciu wartości Kso, to roztwór stałby się nienasycony i osad musiałby się… z powrotem rozpuścić! Jak słusznie zauważyli autorzy drugiego arkusza - osiagnięcie wartości Kso jest górną granicą, przy której nie nastąpi strącenie osadu, a nie dolną, przy której to nastąpi.
Po tej (nie)sławnej próbnej maturze CKE dostałem zresztą pytanie od pewnego ucznia drugiej klasy liceum, czy odpowiedź w kluczu jest na pewno prawidłowa, bo jemu się wydaje, że tutaj nic nie powinno sie strącić, jeśli stężenie będzie równe 2,86·10-3 mol·dm-3, bo to dopiero roztwór nasycony, a nie przesycony. A odpowiedź z klucza nie wyklucza stężenia równego 2,86·10-3 mol·dm-3. Tak, chłopak dobrze myślał, a jeszcze lepiej to o nim świadczy.
Nic dziwnego, że nasza maturzystka odpowiedziała w ten sposób, bo mogła być tak właśnie uczona. I wcale nie była jedyna, która tak odpowiedziała na to zadanie.
A teraz możemy przejść do samego iloczynu rozpuszczalności. Co to tak właściwie jest? Tekst ten miejscami wykracza ponad poziom maturalny.
Iloczyn rozpuszczalności jest jednym z zagadnieniem, na które powinno się zwrócić szczególną uwagę. Po pierwsze, wszyscy jesteśmy uświadamiali oni, że w przypadku takich związków, jak na przykład BaSO4, który nieznacznie rozpuszcza się w wodzie. Możemy zapisać stan równowagi pomiędzy ciałem stałym a roztworem nasyconym, bo każdy roztwór nasycony to jest układ w stanie równowagi z ciałem stałym, którym jest substancja rozpuszczona w tym roztworze.
BaSO4(s) ⮂ Ba2+(aq) + SO42-(aq)
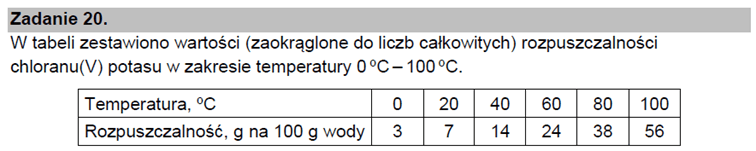
W temperaturze 25°C w litrze (czyli 1 dm3) wody rozpuszcza się zaledwie 0,0024 g BaSO4. Oznacza to, że w litrze wody rozpuszcza się 1,03·10-5 mol tej soli. Rozpuszczalność molowa wynosi 1,03·10-5 mol na 1 dm3 wody. A jakie jest stężenie roztworu? Musimy podzielić liczność (liczbę moli) przez objętość roztworu:
C=n/V
Objętość wody znamy. Jeśli założyć, że objętość roztworu jest równa sumie objętości, to potrzebujemy jeszcze objętość BaSO4. Łatwo obliczyć, że przy gęstości 4,49 g/cm3 zajmie on objętość 0,00053 cm3. Albo 0,00000053 dm3. Rzeczywiście objętość roztworu jest prawie równa sumie objętości mieszanych składników. A zatem w naszym przypadku będzie to 1,00000053 dm3, a jeśli dodatkowo uwzględnić kontrakcję, to będzie to jeszcze bardziej zbliżone do jednego dm3, np. 1,00000050 dm3. Ale podstawmy sumę objętości:
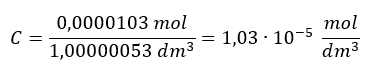
Zwróćmy uwagę na to, że otrzymaliśmy tę samą liczbę, co w przypadku rozpuszczalności molowej. Wynika to z przyjętych zaokrągleń do 3 cyfr znaczących (tutaj: dwóch miejsc po przecinku). Liczby te różnią się bowiem dopiero na szóstym miejscu po przecinku, więc nawet gdyby je podać dokładnością do piątego miejsca po przecinku, to będą sobie równe.
W przypadku związków o bardzo małej rozpuszczalności. Objętość roztworu nasyconego jest praktycznie równa objętości użytego rozpuszczalnika. A stąd:
Cm=R
Jeśli przyjrzeć się równaniu dysocjacji BaSO4:
BaSO4(aq) → Ba2+(aq) + SO42-(aq)
To zauważamy takie zależności:
Liczba moli jonów Ba2+ i SO42- jest równa liczbie moli rozpuszczonego BaSO4, a więc:
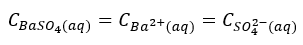
A ponieważ C=R, to:
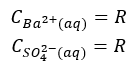
Stąd też stała opisująca równowagę osad-roztwór to:
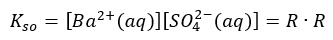
Stąd też stała ta nazywana jest iloczynem rozpuszczalności. I zwróćmy uwagę na to, że napisałem równanie dysocjacji BaSO4 odnosząc sie do tego, co dzieje się z tym zwiazkiem w roztworze. A po raz drugi równanie równowagi osad-roztwór. No i zamiast dwóch strzałek użyłem jednej pisząc równanie dysocacji. Zainteresowane osoby przekonają się, że po coś to było, gdy przejdziemy do CaSO4.
Wynika z tego, że można sobie obliczać bezpośrednio z rozpuszczalności Kso i na odwrót. Jeśli podniosę do kwadratu rozpuszczalność molową BaSO4, to powinienem otrzymać tablicową wartość Kso dla BaSO4. Sprawdźmy:
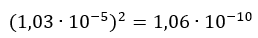
Tablicowa wartość iloczynu rozpuszczalności dla BaSO4 w 25 °C wynosi 1,08·10-10 (dane z CRC Handbook of Chemistry and Phisycs). Wynik jest więc zgodny z oczekiwaniem. Niewielką różnicę można wyjaśnić np. tym, że rozpuszczalność masową mieliśmy podaną z dokładnością zaledwie 2 cyfr znaczących: 2,4 mg na litr wody, a nie np. 2,42 mg w litrze wody. A właśnie ta druga wartość wartość prowadziłaby nas do wyniku 1,08·10-10.
To teraz sobie zadajmy pytanie: Dlaczego w wielu przypadkach podawana jest dla danej substancji zarówno rozpuszczalność, jak i iloczyn rozpuszczalności? Przecież jedno można sobie zawsze przeliczyć na drugie… Żeby obliczyć iloczyn rozpuszczalności, wystarczyłoby po prostu Odparować roztwór nasycony i zważyć pozostałość. To byłoby przecież logiczne.
No to przyjrzyjmy się kilku substancjom: ich rozpuszczalności i iloczynowi rozpuszczalności.
| Związek | R, z tablic mol/dm3 H2O | Kso – obliczony z R | Kso – z tablic | R – obliczona z tablicowych wartości Kso, mol/dm3 H2O |
| BaSO4 | 1,03·10-5 | 1,06·10-10 | 1,08·10-10 | 1,04·10-5 |
| CaSO4·2H2O | 1,51·10-2 | 2,27·10-4 | 4,93·10-5 | 0,70·10-2 |
| CaCO3 | 1,30·10-4 | 1,69·10-8 | 3,36·10-9 | 5,80·10-5 |
| AgCl | 1,33·10-5 | 1,77·10-10 | 1,77·10-10 | 1,33·10-5 |
| PbI2 | 1,65·10-3 | 1,79·10-8 | 9,80·10-9 | 1,35·10-3 |
Zauważmy, że tylko w 2 z 5 przypadków uzyskaliśmy jakąś zgodność wyników. Rozbieżności pozostałych nie da się wyjaśnić tym, że znaliśmy rozpuszczalność, niezbyt dokładnie.
Co więc tak naprawdę określa wielkość zwana powszechnie iloczynem rozpuszczalności? Określa równowagę pomiędzy ciałem stałym a jonami powstałymi z jego dysocjacji w roztworze. A zatem nie uwzględnia różnych innych zjawisk, które mogą następować właśnie w tym roztworze.
Jeśli ich nie ma, wtedy rzeczywiście wartość stałej równowagi osad-roztwór może być obliczona wprost z rozpuszczalności i nazywanie tej wielkości iloczynem rozpuszczalności nie będzie nadużyciem.
Ale co się dzieje np. w roztworze węglanu sodu? Ma on odczyn zasadowy wskutek hydrolizy anionowej (dysocjacji zasadowej anionów węglanowych).
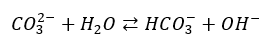
Proces ten zachodzi także w roztworze węglanu wapnia. Powoduje on, że stężenie anionów węglanowych maleje, aby więc zachować równowagę pomiędzy osadem a jonami węglanowymi i jonami wapnia, musi się rozpuścić kolejna porcja osadu. Stąd też rzeczywista rozpuszczalność węglanu wapnia jest wyższa niż wynika z iloczynu rozpuszczalności, a w roztworze tej soli jest zachowana równość:
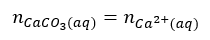
Ale już nie ma równości:
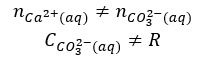
Podręcznikowe wyrażenie na iloczyn rozpuszczalności CaCO3 w tej postaci:
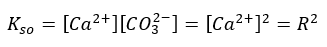
NIE JEST PRAWDZIWE!
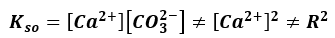
Bo stężenie kationów wapnia jest wyższe niż stężenie anionów węglanowych. A więc takie zadania jak np. to, to duże uproszczenie.


A wyniki przez pierwiastkowanie wartosci iloczynu rozpuszczalności - nie odnoszą się do rzeczywistości.
Ponadto, nawet związki jonowe po rozpuszczeniu w wodzie nie muszą być całkowicie zdysocjowane. W szkole się o tym na ogół nie mówi, ale, niestety, nawet wielu chemików nie ma świadomości tego, że w roztworach mogą istnieć pary jonowe, bo przecież kationy i aniony się przyciągają. A o dysocjacji mówimy dopiero wtedy, kiedy kation i anion są rozdzielone i poruszają się niezależnie od siebie. Ot, w przypadku CaSO4 w nasyconym wodnym roztworze o temp. 25 °C stopień dysocjacji wynosi 67%. Pozostałe 33% jest w postaci par jonowych, które oznaczyłem jako [Ca2+,SO42-].
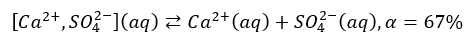
Lub nieco prościej mógłbym to zapisać tak, jak wczesniej zrobiłem w przypadku dysocjacji BaSO4, tylko że tutaj muszę użyć już strzałek równowagi, bo to proces odwracalny.
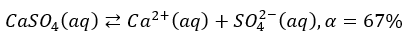
Tak więc i tutaj wartość stałej równowagi osad-roztwór NIE jest tożsama z kwadratem rozpuszczalności, bo mamy tutaj równowagę złożoną:
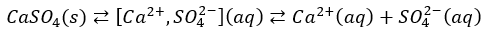
To co powszechnie nazywamy iloczynem rozpuszczalności rozpatruje równowagę pomiędzy osadem, a jonami powstałymi wskutek dysocjacji tej substancji w roztworze – a stężenie jonów nie zawsze jest tożsame z rozpuszczalnością molową.
Sytuacja jeszcze bardziej się skomplikuje, jeśli w roztworze nie tylko dochodzi do częściowej dysocjacji par jonowych, co i do hydrolizy. Zjawiska te powodują, że stałą równowagi zwaną iloczynem rozpuszczalności wyznacza się innymi metodami niż odparowanie. Roztworu nasyconego i zważenie pozostałości. Dominują metody pomiaru przewodnictwa lub najczęściej metoda potencjometryczna.