Wśród pytań dotyczących tegorocznej matury z chemii wiele dotyczy możliwości odwołania w zadaniu 12.1. Wiele osób udzieliło takiej lub podobnej odpowiedzi i odpowiedź uznano za błędną.

Co ciekawe, to takie błędne zapisy można spotkać w odpowiedziach do matury udostępnionych przez różne osoby w Internecie. Wiele osób sugeruje się nimi i jest przekonana, że ich odpowiedź jest poprawna i mogą się od tego odwołać. I szukają kogoś, kto im to odwołanie napisze...
Niestety, ale takie odpowiedzi są nieprawidłowe, a część maturzystów została wprowadzona w błąd i ma złudną wiarę, że ich odpowiedź jest prawidłowa, ale nie została zaliczona ze względu na słynny klucz - trzeba w niego trafić...
Bywają kontrowersyjne przypadki, ale nie tym razem. Wychodzi na to, że od ludzi zdających wymaga się znajomości zapisu schematu ogniw w konwencji sztokholmskiej, ale nie zawsze miały się jak tego nauczyć... Zauważyłem, że to dość pospolita zagwozdka, bo takie pytania:
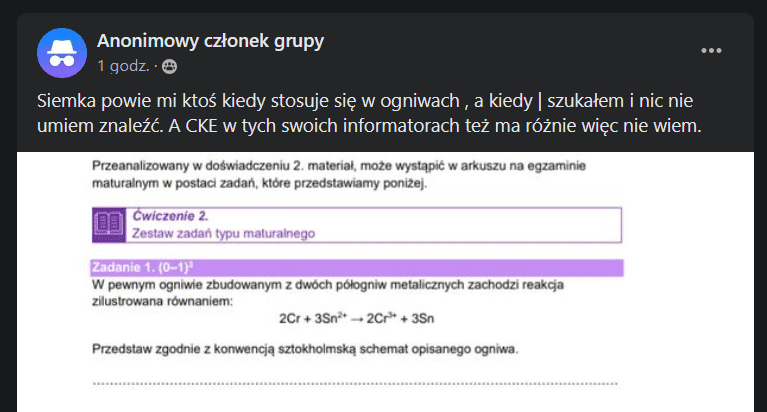
widzę nie po raz pierwszy. Spójrzmy więc na fragment II części podręcznika "Podstawy obliczeń chemicznych":

Tak jak pisałem - pytania takie się powielają, więc zawarłem krótko podstawową zasadę w swoim podręczniku. Zwróćmy uwagę na to, że pionowa kreska oznacza granicę faz. W przypadku ogniwa zapisanego schematem:
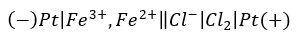
oznacza to tyle:
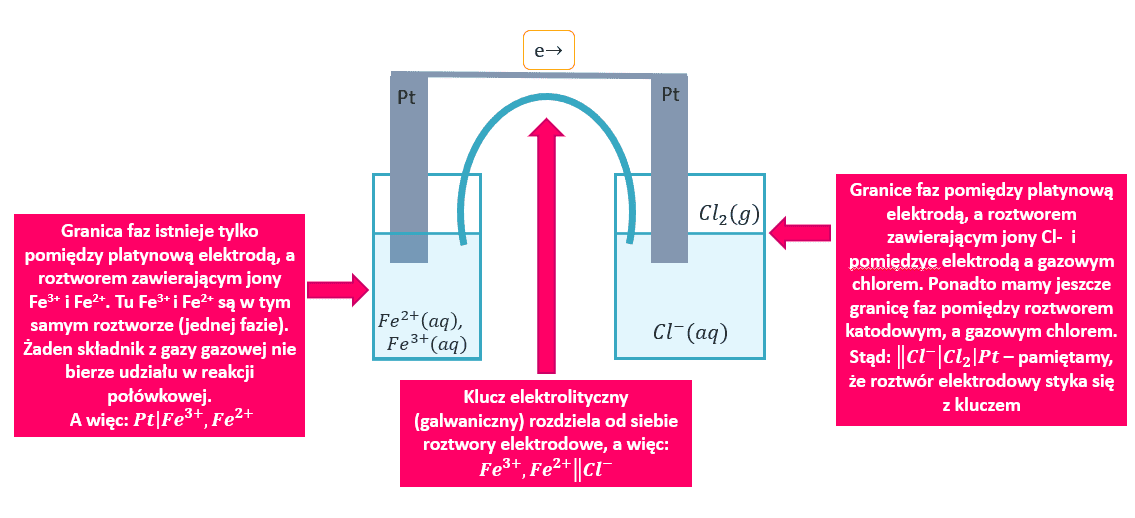
Otrzymujemy zatem:
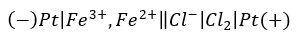
A co w przypadku zadania 12.1? Spójrzmy do schematu oceniania:
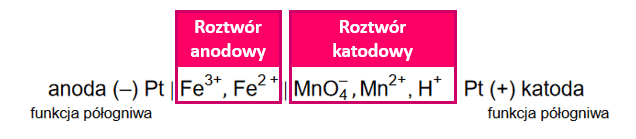
Oznacza to tyle:
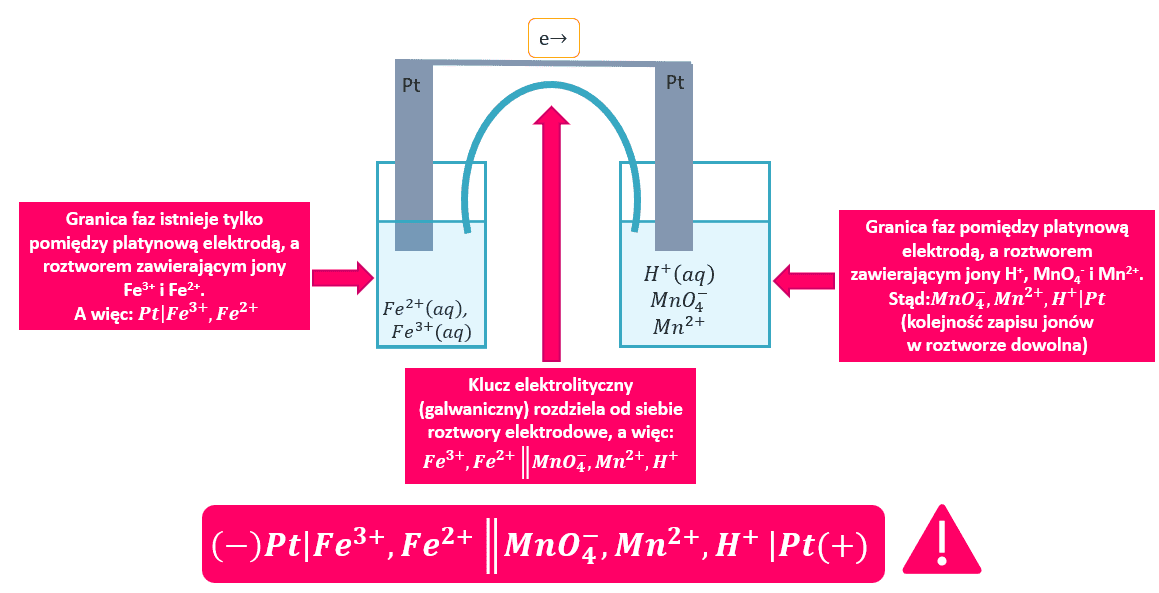
No dobrze, ale jak popatrzymy na zadanie nr 32 z informatora:
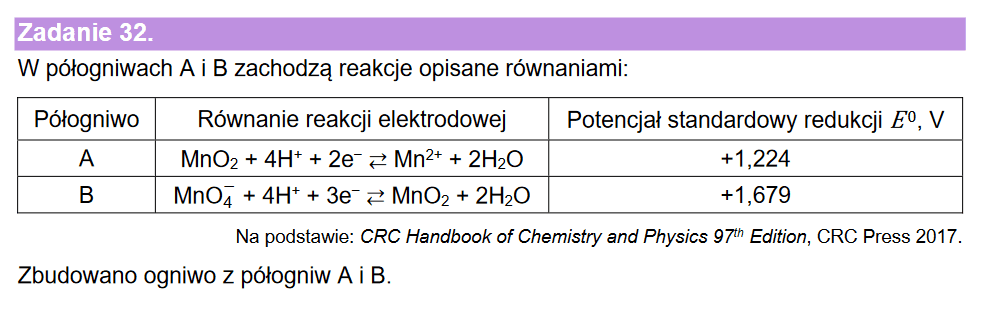
To schemat takiego ogniwa w konwencji sztokholmskiej wygląda następująco:
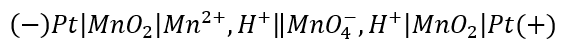
Co wynika stąd, MnO2, jako substancja praktycznie nierozpuszczalna w wodzie - jest osadzona na elektrodzie. I to zarówno na katodzie, jak i na anodzie. W każdym półogniwie mamy więc granice faz: elektroda-MnO2 i MnO2-roztwór elektrodowy. Zarówno na katodzie jak i na anodzie masa MnO2 przyrasta wskutek reakcji synproporcjonowania.
Gdybyśmy w naszym poczciwym ogniwie Daniella:
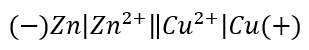
Wymienili katodę na elektrodę chlorosrebrową, to otrzymamy coś takiego:
Czy potraficie już wyjaśnić, dlaczego?