Istotne wiadomości na początek
Hybrydyzacja orbitali atomowych to pojęcie, z którym spotykamy się już w szkole – jest to operacja matematyczna wykonywana na matematycznym modelu atomu. Nie na prawdziwym atomie, bo orbitale nie istnieją w rzeczywistości, podobnie jak w rzeczywistości nie istnieje sinus czy funkcja kwadratowa. To pojęcia abstrakcyjne. Tak samo hybrydyzacja nie jest zjawiskiem, jak mówią niektórzy. Dodanie jedynki do sinusa jakiegoś kąta (sina + 1) to także nie jest zjawisko. To nie jest coś, co zachodzi, co ma miejsce. To tylko abstrakcja. popatrzmy wokół siebie i pokażmy komuś: „Patrz! Tu zachodzi zjawisko dodawania jedynki do sinusa kąta a!”. Ale choć jest to abstrakcja to jednak takimi matematycznymi modelami atomu się posługujemy, aby go jakoś opisać i przewidzieć pewne rzeczy (zjawiska), którym ulegają prawdziwe atomy. Poprawniej jest mówić, że atomowi przypisuje się jakiś typ hybrydyzacji/orbitalom walencyjnym atomu przypisuje się jakiś typ hybrydyzacji, albo że atom zachowuje się tak, jakby miał typ hybrydyzacji. Co więcej, w praktyce bywa z tym różnie… Już na poziomie ponadszkolnym często się mówi np. że jakiś atom zachowuje się tak, jakby miał 80% udziału hybrydyzacji sp3 i 20% sp2 – czyli takie sp3, ale nie do końca… Ojcem tego pojęcia jest Linus Pauling.
sp3, sp2 i sp…
To trzy podstawowe typy hybrydyzacji, znane w sumie każdemu chemikowi i nawet uczniom klas biolchemowych. W wyniku nałożenia orbitalu typu s i trzech orbitali typu p otrzymujemy 4 nowe orbitale hybrydowe, oznaczane sp3. Ze względu na odpychanie elektronów orbitale są tak ustawione, by to odpychanie było jak najmniejsze, czyli elektrony sobie wzajemnie jak najmniej przeszkadzały. W przypadku hybrydyzacji typu sp3 te 4 hybrydy są ukierunkowane w naroża czworościanu foremnego (tetraedru). Oczywiście w wyniku hybrydyzacji nie otrzymujemy tetraedru, tylko orbitale są ukierunkowane (zorientowane) w jego naroża. Nasz atom nie staje się tetraedrem, tylko orbitale są ukierunkowana od centrum do naroży wyimaginowanego tetraedru.
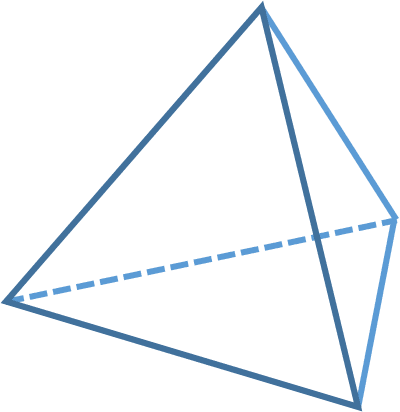
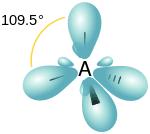
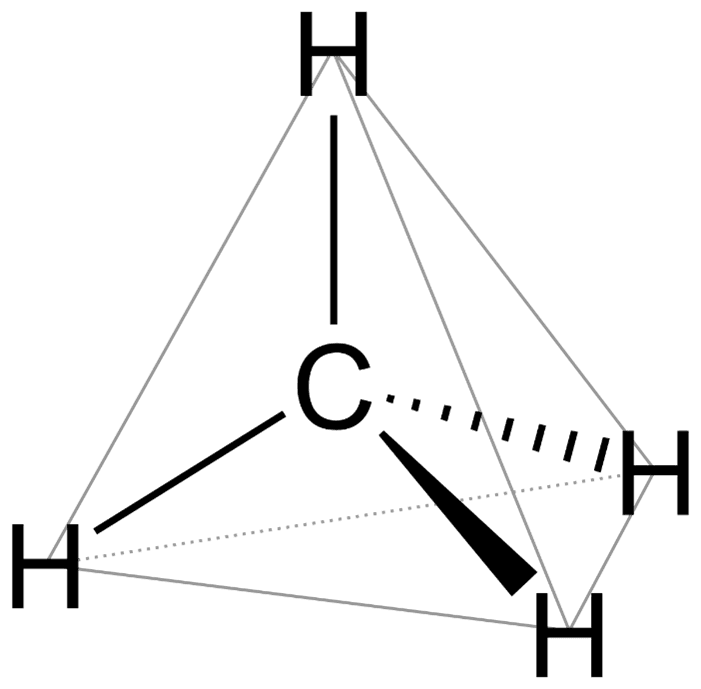
Cząsteczki o takiej geometrii nazywamy tetraedrycznymi (no albo czworościennymi). Bo orientacja przestrzenna jest taka sama jak orientacja z hybrydyzowanych orbitali atomu węgla. Z tego powodu zarówno o hybrydyzacji, jak i o kształcie cząsteczki mówimy, że są tetraedryczne. Albo mówi się, że atom jest tetraedryczny, często tak się mówi o atomie węgla. To jest logiczne: tetraedryczny, bo ma coś z nim wspólnego z kształtem/geometrią tetraedru.
No właśnie tetraedryczne, bo mają coś wspólnego z kształtem tetraedru…
I tutaj się na chwilę zatrzymamy. Od pewnego czasu można spotkać stwierdzenia, że orientacja orbitali zhybrydyzowanych jest w kierunku naroży tetraedru, ale hybrydyzacja jest tetraGONALNA.
A zatem wyjaśnijmy sobie, że tetraGON to po polsku czworoKĄT - figura płaska. Podobnie pentagon to pięciokąt, trygon to trójkąt itd. A tetraedr to po polsku czworoŚCIAN - figura przestrzenna. Nie nazwiemy piramidy egipskiej trójkątem, bo to figura przestrzenna Piramida a nie trójkąt, choć jej boczna ściana jest trójkatem. Piramida egipska jest pentaedrem o tetraGONALNEJ podstawie, bo u podstawy mają kwadrat (tetragon) - figurę płaską (2D). Piramidy, które mają u podstawy czworokąt nazywamy tetragonalnymi. Przymiotnik tetragonalna w jakiś sposób nawiązuje do tego, że gdzieś ten tetragon jest. Ale tutaj odnosi się tylko do podstawy, w żaden sposób nie dotyczy to całości piramidy. Ale gdzieś jest ten tetragon, czyli czworokąt. Bardziej po polsku takie piramidy nazywamy kwadratowymi lub czworokątnymi. A piramidy, które mają podstawy trójkąt, nazywamy trójkątnymi lub trygonalnymi.

Piramida Cheopsa ma łącznie 5 ścian (podstawę i 4 ściany boczne), w związku z czym nie jest pentagononem, nie jest pentagonalna, tylko jak już to jakimś pentaedrem/pentaedryczna, czyli pięciościanem/pięciościenna. Ale niekoniecznie figurą foremną.
A hybrydyzacja typu sp2 to układ orbitali leżący w jednej płaszczyźnie w naroża trójkata równobocznego. Jest to układ PŁASKI więc nazywamy to hybrydyzacją trygonalną (po polsku: trójkątną). Ale w przypadku sp3 mamy układ przestrzenny układajacy sie w naroża czworościanu a nie czworokąta, bo to byłaby wzajemna sprzeczność: tetragon, taki jak kwadrat - to układ płaski.
Nawet w przypadku układów krystalicznych układy o podstawie kwadratu czy prostokąta nazywa się układami tetragonalnymi (czworokątnymi) bo podstawą jest czworokąt. Znowu jest jakiś związek z tym tetragonem.
Tymczasem od kilku lat obserwuję dość dziwną tendencję w podręcznikach szkolnych do nazywania hybrydyzacji sp3 jako tetragonalna (czworokątna? Kwadratowa?) zamiast tetraedryczna. Pardon - ale jakie to ma uzasadnienie? Nawet gdyby ktoś powoływał się na jakaś analogie do nazewnictwa systemów krystalicznych: tetragonalny, bo ma kwadrat (tetragon) w podstawie, to w przypadku sp3 w podstawie jest nie tetragonu, tylko trygon, bo każda ściana czworościanu jest trójkątem (trygonem)... I byłaby to hybrydyzacja (nomen omen) trygonalna! Kiedyś ktoś o znanym nazwisku się upierał, że maturzyści mają pisać na maturze właśnie hybrydyzacja tetragonalna, a nie tetraedryczna, bo tak jest poprawnie właśnie. Zerknijmy co to na to IUPAC...

Co więc miałoby to mieć wspólnego z tetragonem?
Tych kilka lat temu próbowałem dojść do tego, skąd to się wzięło i najstarsze co znalazłem w swoich poszukiwaniach to pewien angielski podręcznik wydany chyba w 2008 roku. A ponieważ nowe podręczniki pisze się tak, że się przepisuje inne (starsze) podręczniki, to jak ktoś się prawdopodobnie przejęzyczył, to ileś osób tak samo napisało w nowszych podręcznikach. No to jeszcze raz - dlaczego IUPAC nie podaje tutaj nazwy tetraGONALNA?
No to teraz zobaczmy na fragment podręcznika szkolnego, rok wydania 2019:
![]()
![]()
![]()



![]()
![]()
![]()
![]()
![]()


![]()



![]()


![]()
![]()
![]()
![]()


![]()

![]()
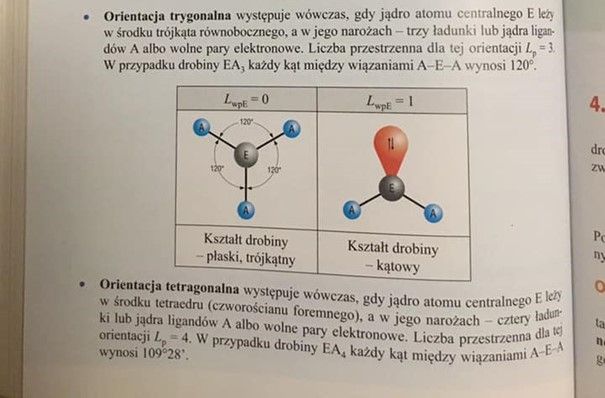
Zobaczmy do innego szkolnego podręcznika – rok wydania także 2019.
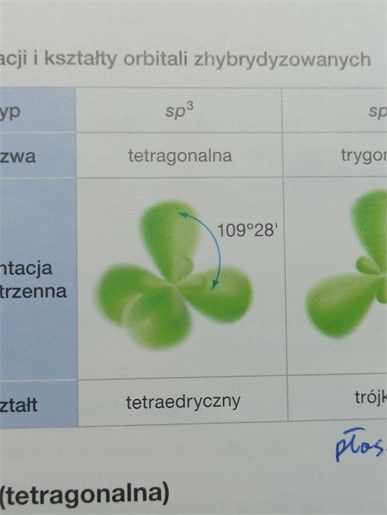
Tu mamy podobną sytuację…
A zobaczmy w opracowanie tego samego wydawnictwa, co na pierwszej fotce, ale z roku 1996:
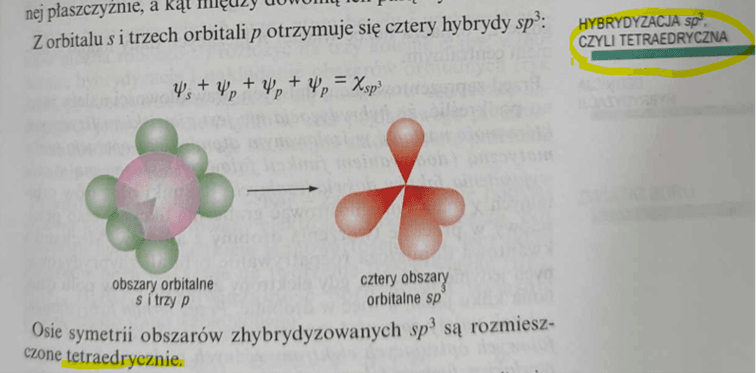
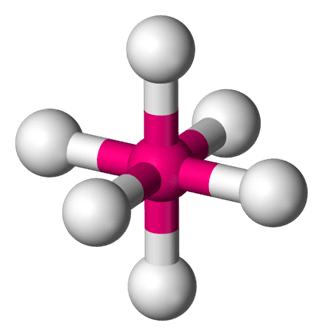
No i wreszcie mamy hybrydyzację d2sp3 – zwaną oktaedryczną, czyli w orientacja w kierunkach naroży bipiramidy tetraGONalnej, czyli oktaedru.
Zastanówmy się jednak jeszcze chwilę nad atomem węgla. Taki dichlorometan CH2Cl2 – czy to jest jeden związek, czy też pod tą nazwą mogą kryć się izomery? Ta cząsteczka ma kształt tetraedryczny, ale nie jest to geometria tetraedru foremnego, ze względu na różną długość wiązań C-H i C-Cl.
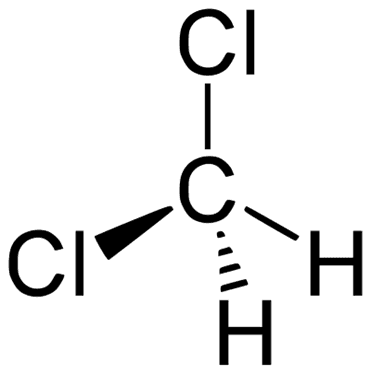
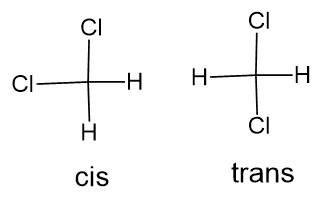
Wyobrażam już sobie: „Mirek, dolej mi potem dichlorometanu do kolumny chromatograficznej!” „Dobra! A którego izomeru?” „Cis, tylko proszę cię: tym razem się, *****, nie pomyl!”.
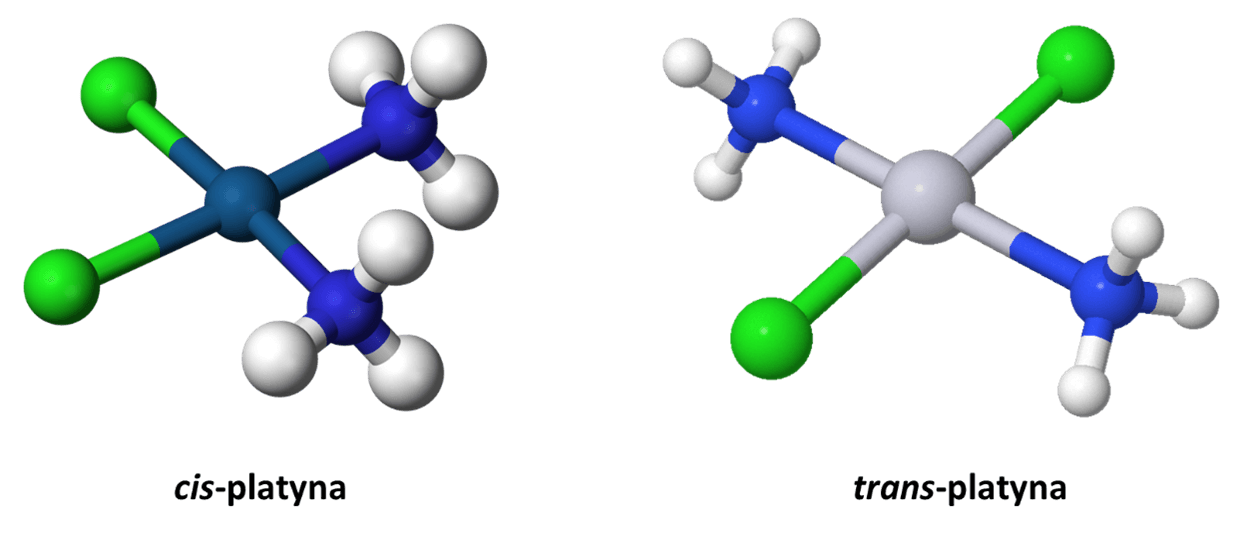
Ale na szczęście atomowi węgla takiej przypisać nie można, wobec czego życie jest prostsze. A czy takie izomery geometryczne istnieją? Jeszcze jak! Ale tam, gdzie można przypisać hybrydyzację tetragonalną, np. tutaj, w przypadku związków platyny, pieszczotliwie zwanymi cis-platyną i trans-platyną.
Ale bliżej szkolnej nauki mogą być pewne kompleks miedzi(II) – ot, szafirowe kompleksy miedzi(II) z aminokwasami:
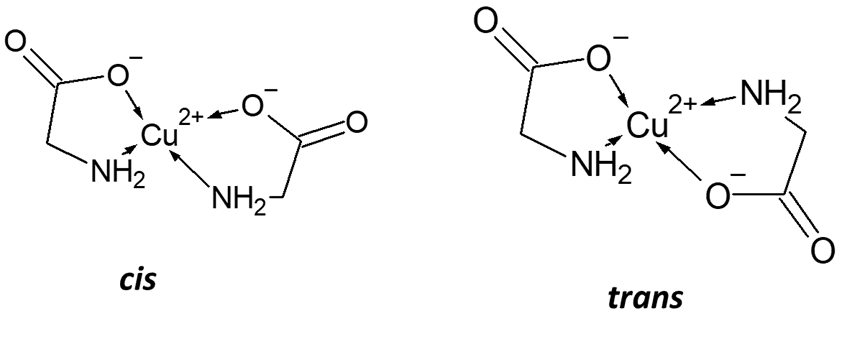
A dlaczego tak? Bo tutaj mamy coś wspólnego z tetragonem, a nie tetraedrem…