W tym materiale zapoznasz się z pewnymi zagadnieniami, z którymi zmierzyli się maturzyści w 2017 roku. Co jest w nim ciekawe, że poświęciłem mu cały artykuł? Zadanie obnaża pewne niedociągnięcia edukacyjne, dlatego warto je przeanalizować, bo wiele ludzi ma problem z prawidłową odpowiedzią do niego. A w ogóle to jeśli masz problem z kinetyką chemiczną, to zapoznaj się z dostępną ZA FREE lub ZA DARMO (jak wolisz) lekcją dostępną tutaj.
Zadanie wyglądało następująco:
W procesie parowego reformingu metanu (konwersji metanu z parą wodną) w pierwszym
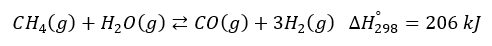
Poniżej zestawiono warunki, w jakich przeprowadza się opisany proces parowego reformingu
I temperatura około 1070 K
II ciśnienie około 3 · 104 hPa
III katalizator niklowy
IV stosunek molowy 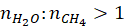
Dokończ poniższe zdania – wpisz numery wszystkich warunków prowadzenia procesu,
1. Warunki sprzyjające dużej szybkości reakcji: ......................................................................
2. Warunki sprzyjające dużej wydajności reakcji: ....................................................................
I teraz przyjrzyjmy się poprawnym odpowiedziom.
1. Warunki sprzyjające dużej szybkości reakcji: I, II, III
2. Warunki sprzyjające dużej wydajności reakcji: I, IV
I tutaj wiele osób ma dylemat, dlaczego „w kluczu” Przy warunkach sprzyjających dużej szybkości reakcji w odpowiedzi brakuje stosunku molowego 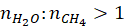 . Przecież wprowadzając więcej wody (pary wodnej), zwiększamy jej stężenie, a więc i szybkość reakcji… I takie zadania też nieraz spotykaliśmy w zbiorach. Dlaczego więc tutaj nie ma tej odpowiedzi? Czy jest to kwestia mitycznego klucza? Wyjaśnimy to sobie bowiem zadanie na zadanie to warto zwrócić uwagę, zwłaszcza w kontekście najbliższej matury, gdyż forma zadań w formule 2023 wnosi pewien element nowości i jest mniej oklepana niż powtarzane zadania w szkole czy w zbiorach zadań.
. Przecież wprowadzając więcej wody (pary wodnej), zwiększamy jej stężenie, a więc i szybkość reakcji… I takie zadania też nieraz spotykaliśmy w zbiorach. Dlaczego więc tutaj nie ma tej odpowiedzi? Czy jest to kwestia mitycznego klucza? Wyjaśnimy to sobie bowiem zadanie na zadanie to warto zwrócić uwagę, zwłaszcza w kontekście najbliższej matury, gdyż forma zadań w formule 2023 wnosi pewien element nowości i jest mniej oklepana niż powtarzane zadania w szkole czy w zbiorach zadań.
Rozpatrzymy najpierw taki przypadek, z perspektywy którego wiele osób podchodzi do tego zadania - perspektywy tego, jak prawdopodobnie nauczono nas podchodzić do tego typu zadań. Wprowadzamy nadmiar pary wodnej do układu reakcyjnego – stężenie wody (pary wodnej) rośnie… Jeśli potraktować mieszaninę reakcyjną jako gaz doskonały, to możemy obliczyć stężenie składników mieszaninie reakcyjnej z równania stanu gazu doskonałego.
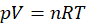
A jednocześnie wiemy, że stężenie molowe to liczność substancji (liczba moli) podzielona przez objętość.
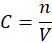
Możemy z równania Clapeyrona wyznaczyć liczbę moli i podstawić otrzymane wyrażenie na n podstawić do wzoru na C. Otrzymamy wtedy:
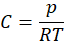
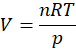
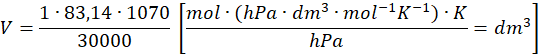
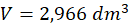
A to oznacza, że nasza objętość molowa wynosi 2,966 dm3·mol-1.
Oczywiście możemy sobie użyć wyprowadzonego wcześniej wzoru na stężenie molowe, ale… Skoro mamy już objętość molową, to zwróćmy uwagę na jej wymiar: dm3·mol-1. Formalnie dzielimy 2,996 dm3 przez 1 mol:
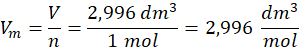
A co, gdy policzymy odwrotność objętości molowej? Sprawdźmy!
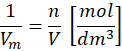
I otrzymaliśmy stężenie molowe! Tak, stężenie molowe jest odwrotnością objętości molowej.
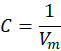
Ta wiedza może Ci się przydać. Ale nieważne, czy stężenie policzymy tak, czy tak jak zaproponowano w maju 2021 na maturze – ważne, że sumaryczne stężenie gazów w warunkach prowadzenia procesu wynosi 0,337 mol·dm-3 w stechiometrycznej mieszaninie pary wodnej z metanem. Po połowie na każdy gaz, czyli po 0,169 mol·dm-3. A gdy będziemy wprowadzać nadmiar pary wodnej, to wzrośnie także jej stężenie.
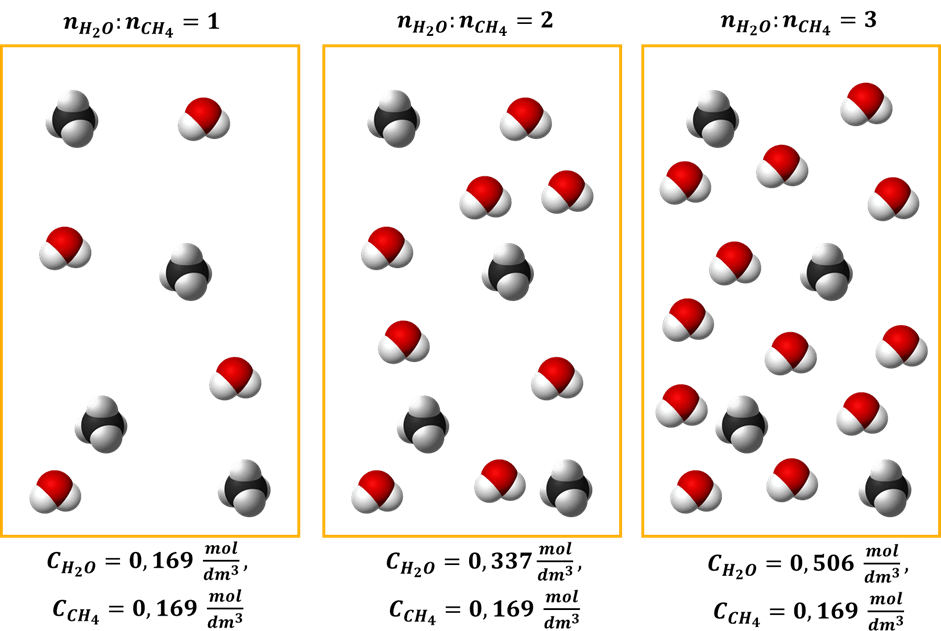
Zadanie nie podaje równania kinetycznego. Ale przyjmijmy, że ma ono postać następującą:
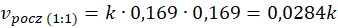
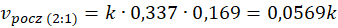
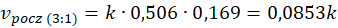
Przy dwukrotnej ilości pary wodnej w stosunku do metanu szybkość początkowa reakcji jest 2 razy wyższa niż przy stechiometrycznym stosunku substratów. A przy trzykrotnej ilości pary wodnej w stosunku do metanu szybkość początkowa reakcji jest 3 razy wyższa niż przy stechiometrycznym stosunku substratów. I rzeczywiście widzimy, że szybkość reakcji rośnie ze wzrostem stosunku molowego pary wodnej do metanu. A jak za zmianą stosunku molowego zmieniło się ciśnienie? Popatrzmy.
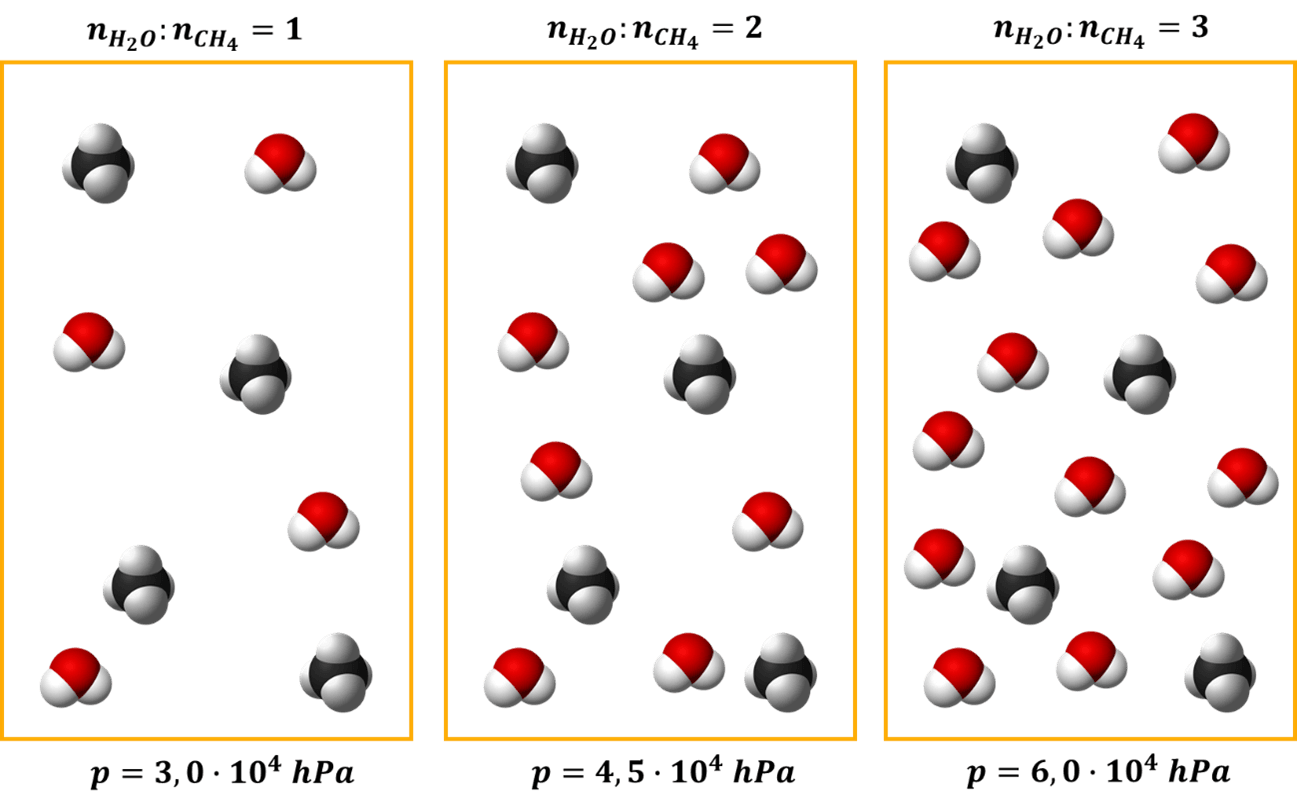
W treści zadania mowa jest o tym, że proces prowadzony jest pod ciśnieniem około 3·104 hPa (30 000 hPa). Czy przy stosunku 2:1 i 3:1 możemy powiedzieć, że jest to dziś proces prowadzony pod ciśnieniem, ok. 3·104 hPa? Nie.
Nie o to chodzi w zadaniu. Byłby to proces pod zmiennym ciśnieniem, bo ciśnienie zależałoby od stosunku molowego substratów. A o takim procesie nie możemy powiedzieć, że jest prowadzony pod jakimś ciśnieniem. W zadaniu chodzi o proces prowadzony w takich warunkach, w którym zmiana stosunku molowego substratów nie powoduje zmiany ciśnienia.
W zadaniu chodzi o procesy, w których objętość mieszaniny może się swobodnie zmieniać w zależności od ilości substratów. Chodzi o proces izobaryczny, czyli pod stałym ciśnieniem. W warunkach stałego ciśnienia zmiana ilości cząsteczek powoduje proporcjonalną zmianę objętości układu.
Popatrzmy na syntezę amoniaku z pierwiastków, którą przedstawia równanie stechiometryczne:
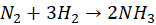
Gdy reakcję tę przeprowadzać w reaktorze o stałej objętości (sztywnych ścianach), to w miarę postępu reakcji w reaktorze spada ciśnienie. Przy całkowitym przereagowaniu osiągnęłoby połowę początkowej wartości.
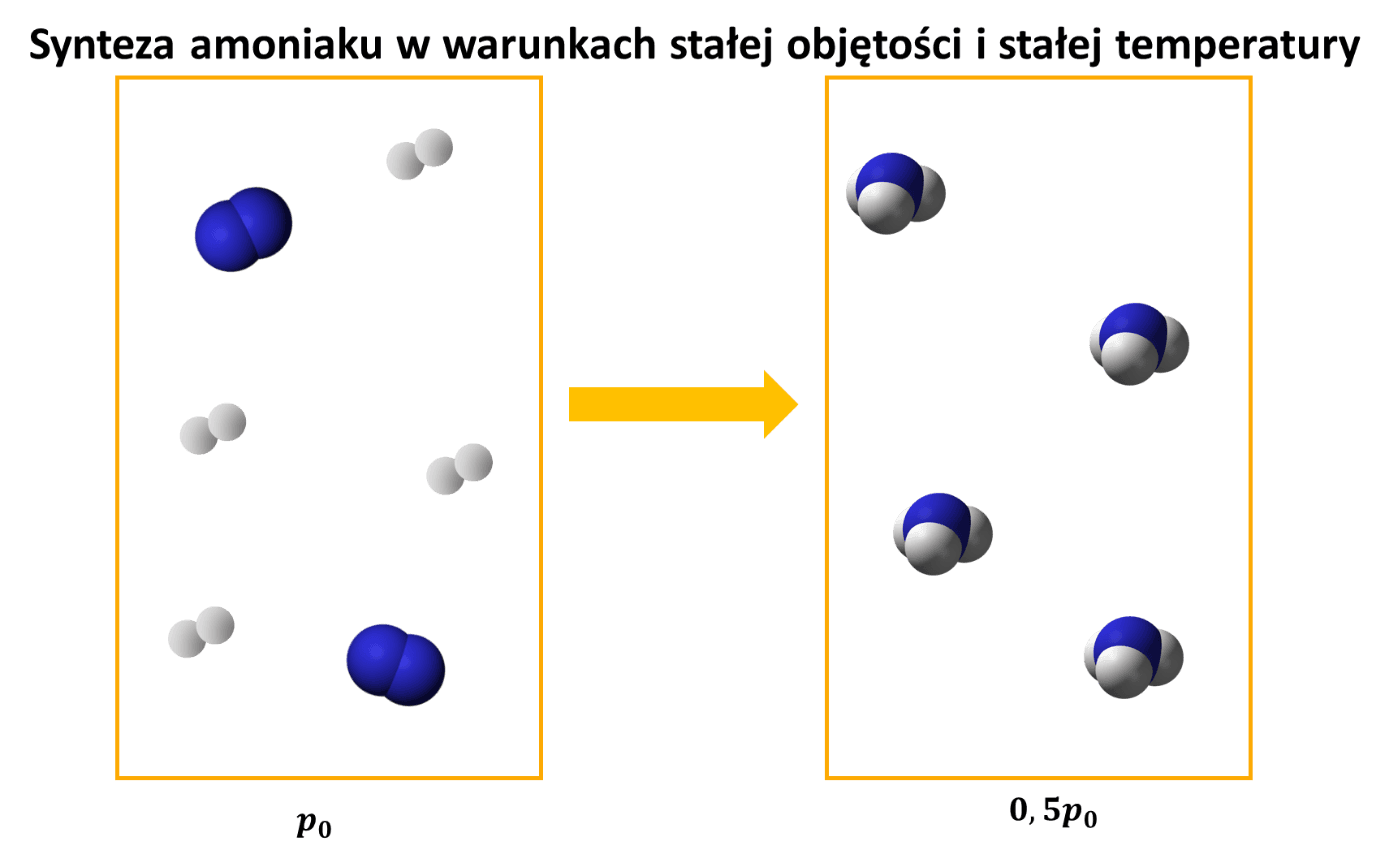
A jeśli wszystkie gazy porównywać w tych samych warunkach ciśnienia i temperatury, to jedna objętość azotu reaguje z 3 objętościami wodoru i daje 2 objętości amoniaku. Z 4 objętości substratów zrobiliśmy 2 objętości produktu. Nie bez powodu mówimy, że jest to reakcja ze zmniejszeniem objętości. Ale warunkiem jest, by było to pod stałym ciśnieniem.
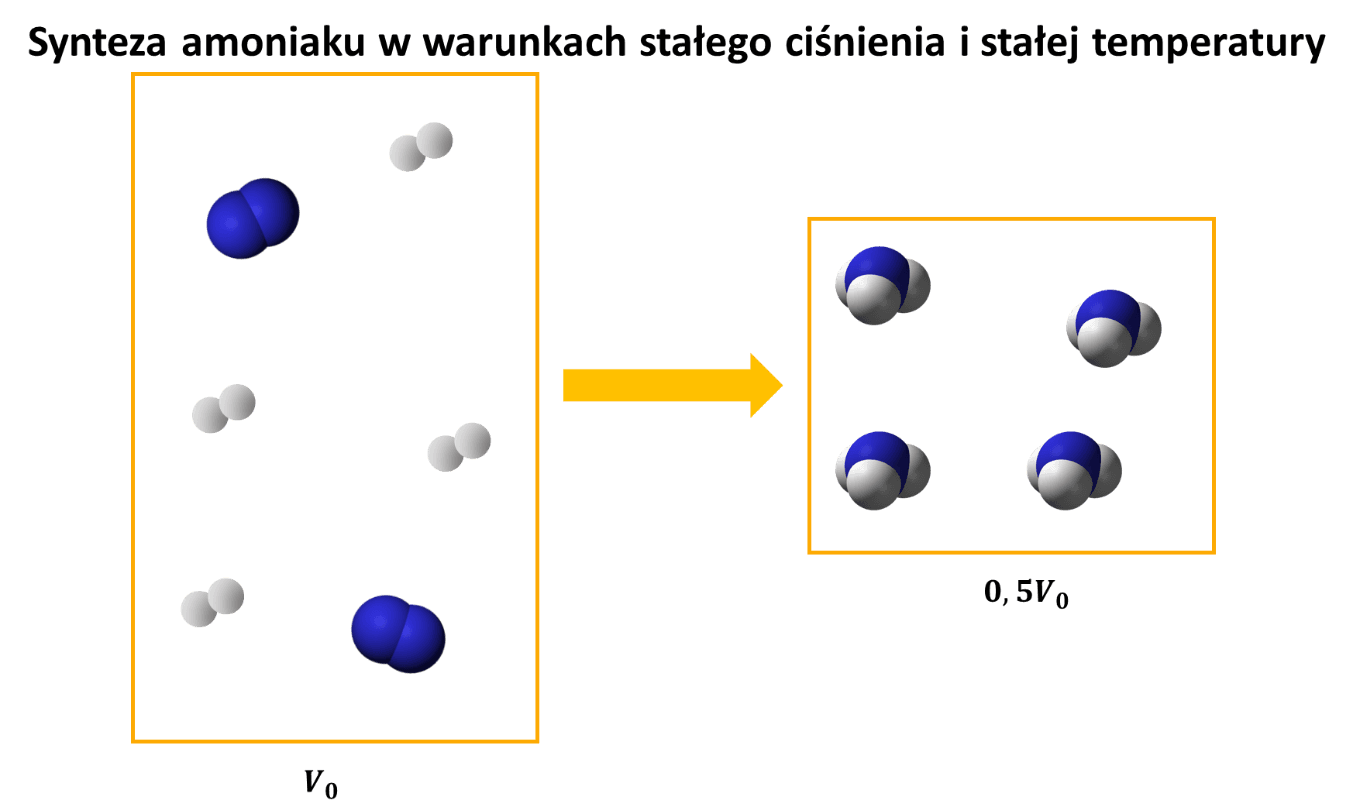
A teraz wracamy do naszego zadania. Jeśli wprowadzimy dwukrotną ilość pary wodnej w stosunku do metanu, to liczba cząsteczek wzrasta o połowę. Ale! Objętość mieszaniny także wzrasta o połowę…
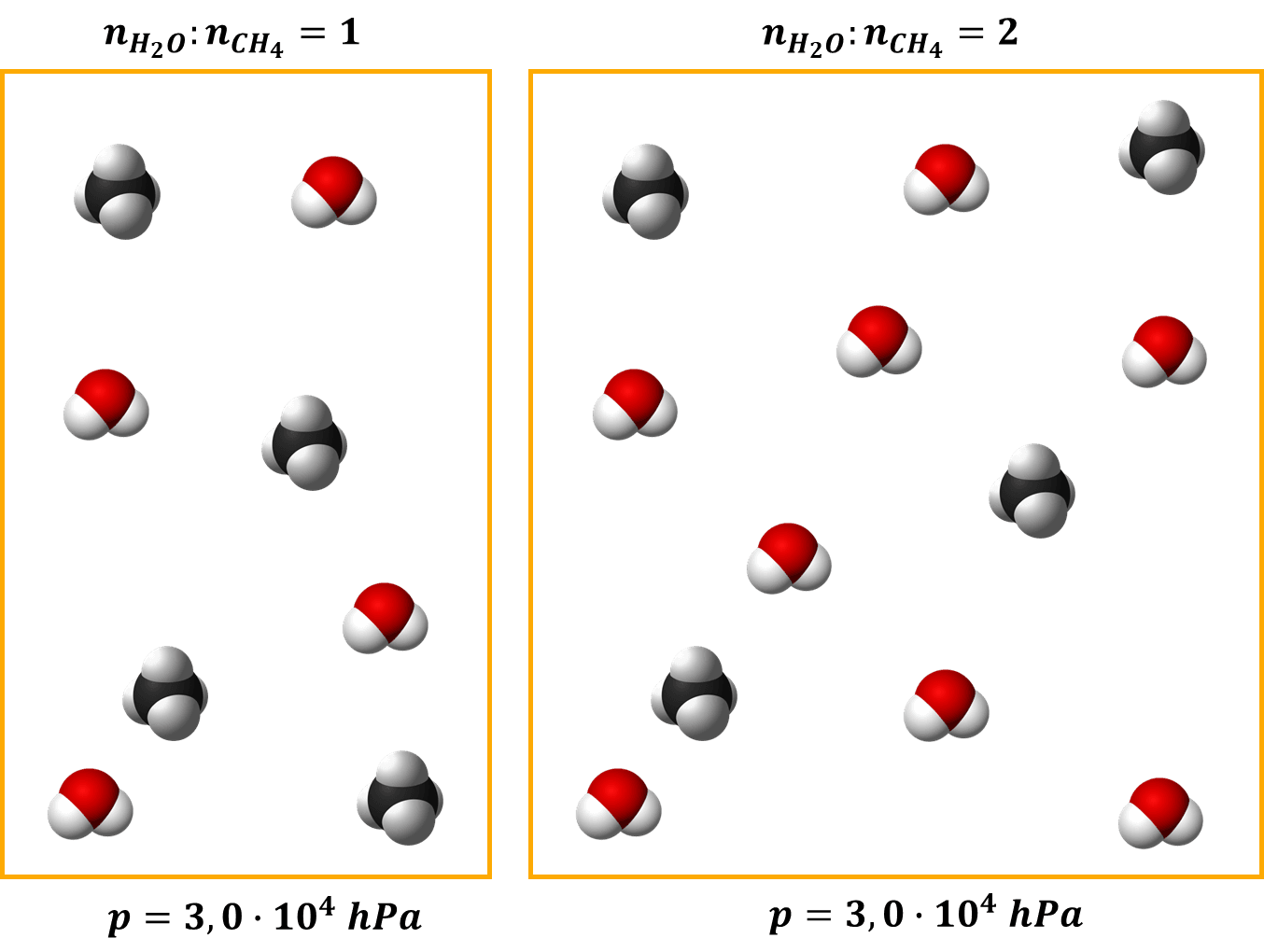
I w obu przypadkach proces prowadzimy pod podanym ciśnieniem, ale przy różnym stosunku molowym substratów. I teraz spróbujmy odpowiedzieć sobie Jeszcze raz na pytanie: Czy podniesienie stosunku molowego pary wodnej do metanu wpłynęło korzystnie na zwiększenie szybkości reakcji?
Znowu musimy się przyjrzeć stężeniom. Przy ciśnieniu 30 000 hPa sumaryczne stężenie substratów i przed i po zmianie stosunku molowego wynosi tyle samo: 0,337 mol/dm3.
O ile sumaryczne stężenie się nie zmienia, o tyle stężenia poszczególnych substratów już tak.
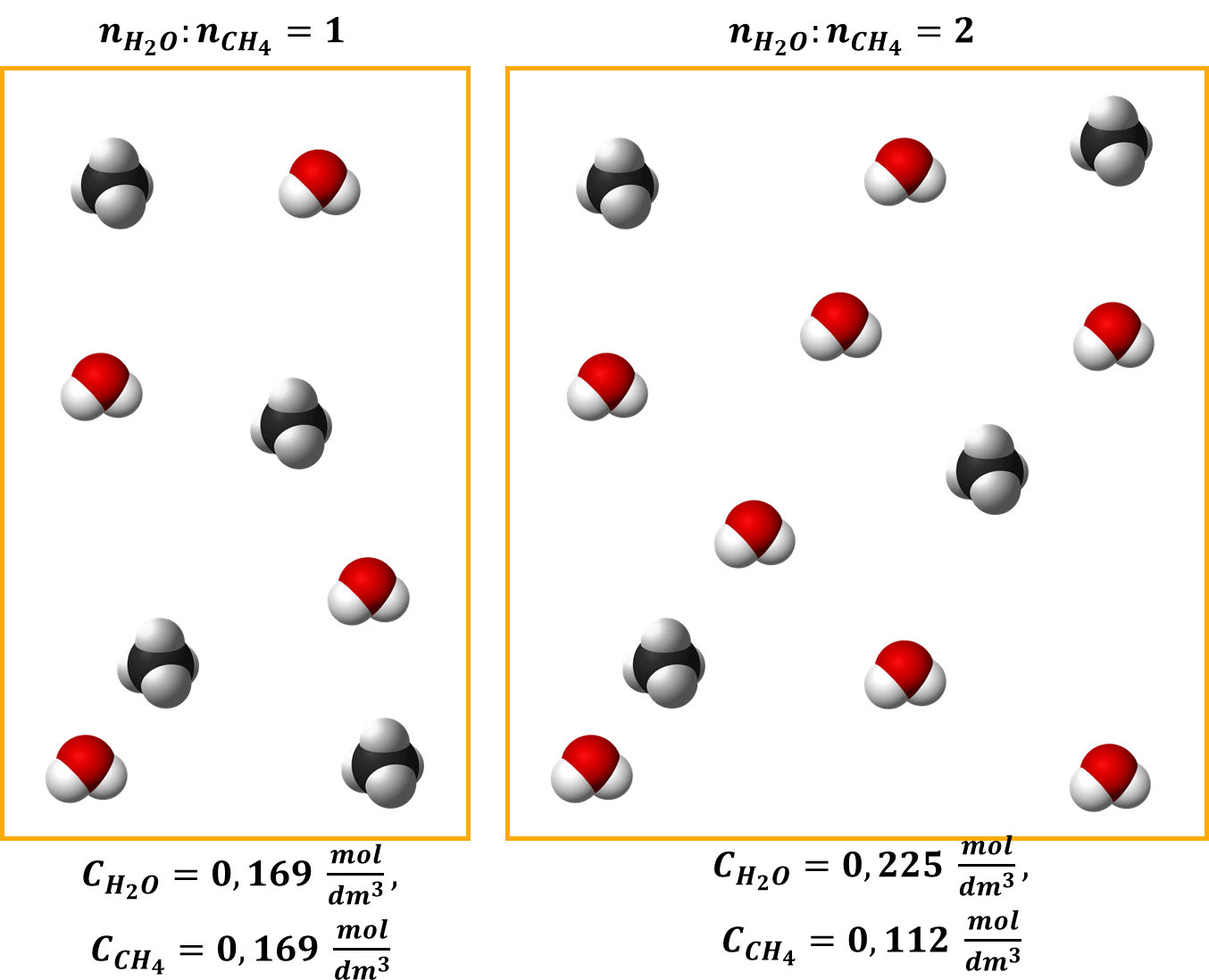
Podobnie jak w poprzednim przypadku, stężenie pary wodnej wzrosło. Ale za to stężenie metanu spadło. Porównajmy więc szybkości reakcji przed i po.
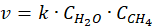
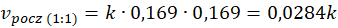
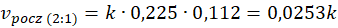
I tu spotkała nas niespodzianka, bo pomimo tego, że stężenie wody wzrosło, To szybkość reakcji spadła. Sprawdźmy, co się stanie, gdy zmienimy tam stosunek na 3 : 1.
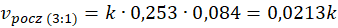
W trzecim przypadku stężenie pary wodnej wzrosło o około połowę w stosunku do stanu wyjściowego. Ale stężenie metanu spadło 2 razy... Suma summarum wychodzi, że szybkość reakcji spada! Czyli przekonujemy się, że wzrost tego stosunku molowego nie jest czynnikiem sprzyjającym dużej szybkości reakcji. A na potwierdzenie swoich słów załączam wykres przedstawiający dane doświadczalne uzyskane w temperaturze 1071 K pod ciśnieniem 120 kPa.
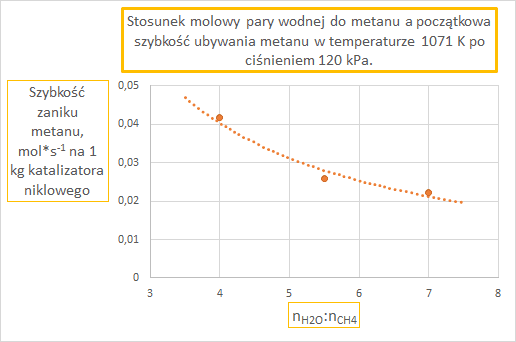
I to nam chyba wystarczy już. Sięgając wstecz pamięcią, mam wrażenie, że nigdy nie spotkałem się z jakimkolwiek zadaniem, które analizowałoby ten problem. Jedynym przypadkiem, gdzie spotkałem się z układem reakcyjnym pod stałym ciśnieniem jest arkusz pokazowy z marca 2022, zadanie 14:

Aczkolwiek to zadanie nie dotyczy szybkości, tylko równowagi reakcji. Ale żeby je rozwiązać, to i tak trzeba uwzględnić zmianę objętości układu podczas tej reakcji.
Bogatszy o pewną wiedzę – przeanalizuj to zadanie. Czy jesteś w stanie dojść do prawidłowego wyniku Kc = 5,71·10-4?
Wyjaśniliśmy sobie, że nadmiar nie zawsze jest korzystny, jeśli o szybkość chodzi. I czy to już koniec? Czy odpowiedź jest już tak klarowna? Jeszcze nie…
Kiedy chcemy utrzymać dużą szybkość reakcji, to bierzemy pod uwagę te czynniki, których wpływ na nią jest duży. Zastosowanie katalizatora przyspiesza reakcję tysiące razy, czasem nawet miliony razy. Tak samo prowadzenie reakcji w wysokich temperaturach. Gdyby obniżyć temperaturę z 1070 do 1000 K, to reakcja mogłaby zwolnić aż 16 000 razy! Zamiast po 30 sekundach, taką samą wydajność osiągnęlibyśmy nawet po 6 dniach! W optymistycznym przypadku z 30 sekund zrobi się 1 h, w pesymistycznym 6 dni. A co, gdyby tę reakcję prowadzić w temperaturach pokojowych? Generalnie wpływ zmiany temperatury także jest zdecydowany. Podniesione ciśnienie to także zwiększone stężenie. Gdyby proces prowadzić pod ciśnieniem atmosferycznym w temperaturze 1070 K, to oznaczałoby stężenia 30 razy mniejsze – w stechiometrycznej mieszaninie początkowa szybkość reakcji byłaby mniejsza aż 900 razy! 900 razy przy założonym równaniu kinetycznym. Jeśli teraz popatrzymy na nasze wyniki, jak nadmiar pary wodnej wpłynął na szybkość reakcji pod stałym ciśnieniem, to widzimy, że wpływ nie jest zbyt duży – reakcja przebiega z porównywalną szybkością. Biegnie nawet wolniej w obecności nadmiaru pary, ale nadal z porównywalną szybkością. Nie jest to czynnik istotny z punktu widzenia kinetyki, by szybkość tej reakcji regulować akurat tym stosunkiem.
A nawet widzimy, że może być niekorzystny. Na pierwszy rzut oka.
Ale powiedzcie mi, czy na pierwszy rzut oka wszystko ocenimy właściwie? Nie pomylimy się? No? No? No właśnie! W kwestiach kinetycznych pod kątem osiągnięcia dużej szybkości reakcji nie jest to brany pod uwagę czynnik z wymienionych już wcześniej powodów. Ale nie oznacza to, że nie wiąże się z tym żadna korzyść, nawet kinetyczna. Widzimy, że szybkość reakcji spadła w nadmiarze pary wodnej. Tyle że jest to szybkość początkowa… A co, gdy przereaguje połowa metanu? Przyjrzyjmy się temu jeszcze raz…
Tak więc jak będzie szybkość reakcji, gdy przereaguje połowa metanu?
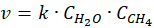
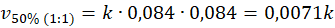
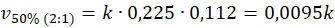
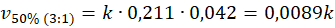
I tu mała niespodzianka. Nadmiar pary wodnej przynosi niewielki korzystny wpływ – pozwala utrzymać nieco większą szybkość reakcji w jej trakcie. Choć początkowa szybkość reakcji była najmniejsza przy stosunku 3 : 1, to wcale nie musi się okazać, że najmniejszy stopień przereagowania po tym samym czasie osiągniemy właśnie przy takim stosunku. Ale i tak we wszystkich trzech przypadkach będą to zbliżone wartości. Niewielki plus może jednak być. Tutaj uwaga! Ta sytuacja nie dotyczy równowagi, tylko nadal szybkości: jaki stopień przereagowania (i wydajność) otrzymamy po pewnym czasie, a nie, gdy reakcja osiągnie już swój stan równowagi.
Niemniej – znowu widzimy, że tym stosunkiem cudów nie zdziałamy (i jakże to brzmi, gdy piszę te słowa jadąc niedzielnym pociągiem, który chwilę wcześniej miał postój w Częstochowie, a siedząca obok emerytka odmawiała przed chwilą różaniec). Co innego jest tutaj istotne.
A jeśli czujesz pewien niedosyt, to polecam ci II część podręcznika "Podstawy obliczeń chemicznych" :) a także na swoje lekcje online :)
Dane eksperymentalne zaczerpnięte z: K. Hou, R. Hughes: "The kinetics of methane steam reforming over a Ni/a-Al2O3 catalyst", Chemical Engineering Journal, wolumin 82 (2001), strony 311–328.