O ile zdecydowana większość ludzi nie ma problemów z określeniem, czy proces jest egzotermiczny, czy endotermiczny na podstawie znaku entalpii przemiany, o tyle problem robi się, gdy trzeba zrobić to samo na podstawie zmiany temperatury układu. Rozpatrzymy to tutaj na przykładzie, gdzie jedynym efektem jest wymiana ciepła.
Przyjrzyjmy się temu zadaniu z próbnej matury UJ, o które ostatnio padają pytania.


Wiele osób ma problem z udzieleniem prawidłowej odpowiedzi, ponieważ sądzą, że skoro roztwór jest chłodniejszy, to znaczy, że układ oddał ciepło do otoczenia.
A jednak jest to błędny wniosek. W typowym szkolnym podejściu im mniej nauki (przez ciągle eksperymenty z obcinaniem zakresu wymagań) tym więcej tak naprawdę do nauki, bo jest coraz więcej niedopowiedzeń i trudności w zrozumieniu materiału. Jest coraz więcej na zasadzie „zapamiętaj, że”, ale coraz mniej dostrzegania spójności w tym wszystkim. Obecnie wymagania mówią, że uczeń ma odróżniać proces na podstawie znaku entalpii przemiany. I tylko tyle… Bez wyjaśnienia co i jak… A zatem do rzeczy.
Ciepło zawsze jest przekazywane samorzutnie w kierunku niższej temperatury. Czyli od temperatury wyższej do temperatury niższej.
Układem jest kubek gorącej kawy, a otoczeniem pokój. Jeśli w moim pokoju temperatura wynosi 22 °C, a kawa ma 90 °C, to ciepło jest przekazywane z układu do otoczenia.

Czyli kawa stygnie.
Z kolei, jeśli w tym samym pokoju umieszczę mrożoną kawę, to układ ma niższą temperaturę niż jego otoczenie.

Otoczenie będzie więc podgrzewać tę kawę.
Z czasem, więc moja mrożona kawa przestanie być kawą mrożoną. W obu przypadkach układ może osiągnąć temperaturę otoczenia, czyli 22 °C. W pierwszym przypadku układ oddał ciepło do otoczenia, a w drugim pobrał ciepło od otoczenia.
Ciała o równej temperaturze, nie przekazują sobie ciepła. Jeśli więc kawa osiągnie tę samą temperaturę, co otoczenie, to wymiana ciepła ustaje. Jeśli w pokoju panuje temperatura 22 °C, to nie jest możliwe, by mrożona kawa osiągnęła temperaturę 30°C pobierając ciepło od otoczenia. Nie jest też możliwe, by ta stygnąca kawa osiągnęła 10°C w pokoju o temperaturze 22 °C. Bo, nawet gdyby jakimś cudem się tak zdarzyło, to przecież kawa o temperaturze 30°C zaczęłaby oddawać ciepło do chłodniejszego otoczenia.
I teraz wracamy do sedna problemu, czy skoro roztwór NH4NO3 ma 11 °C, to oznacza, że układ oddał ciepło? Przyjrzyjmy się:
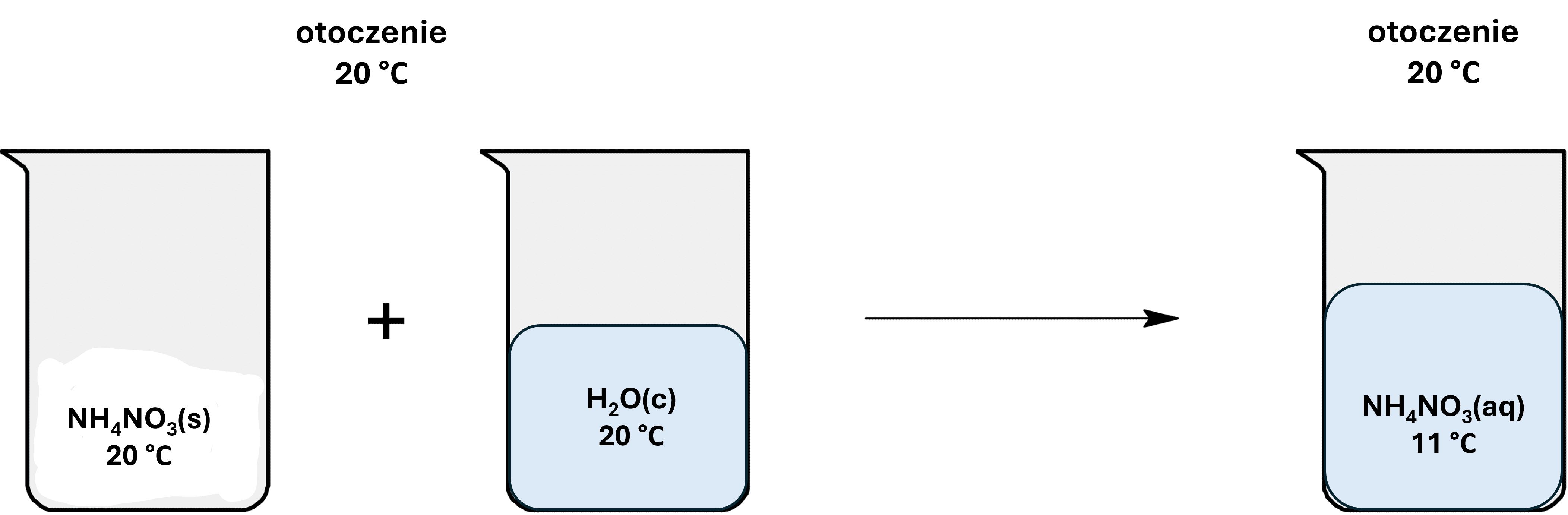
Czy jest więc możliwe, że układ oddał ciepło i dlatego osiągnął temperaturę 11 °C? A w którą stronę teraz popłynie to ciepło, skoro otoczenie jest od układu cieplejsze?
Popatrzmy w drugą stronę. Ponieważ akurat kończy się majówka, to wiele osób (także tegorocznych maturzystów) urządzało grilla w ostatnich dniach. A jak grill to i spalający się poprzez żarzenie się węgiel drzewny. Żarzący się węgiel drzewny ma temperaturę zdecydowanie wyższą niż temperatura otoczenia. Czy on ma wysoką temperaturę dlatego, że pobrał ciepło od otoczenia? Raczej nie. Oddaje ciepło i dlatego możemy sobie upiec karkówkę czy tam kiełbaski, a nawet kaszankę.
Przecież nie rozpalamy w piecu latem po to, żeby wychłodzić w domu, tylko rozpalamy zimą po to, żeby nagrzać w domu. Woda w kaloryferze jest ciepła nie dlatego, że pobrała ciepło otoczenia (pokoju), więc kaloryfera nie odkręcamy po to, żeby sobie wychłodzić w pokoju.
I właśnie to jest rzecz, która przez dziurawość w materiale szkolnym, sprawia problemy wielu osobom. Taka pozorna sprzeczność.
Doszło nawet do tego, że kiedyś przeczytałem na jednej z grup maturalnych: „w rzeczywistości jest odwrotnie, ale na maturze piszemy, że jak temperatura układu rośnie, to proces jest egzotermiczny, a jak spada, to proces jest endotermiczny”. Nie da się nie denerwować czytając takie rzeczy.
Należy sobie zadać pytanie, co to jest tak naprawdę efekt energetyczny? Rozpatrzmy to na przykładzie tego azotanu amonu i wody. Wsypujemy trochę tej soli do wody i mieszamy. Po chwili cała sól uległa rozpuszczeniu. Czy w tym momencie możemy powiedzieć, że w układzie przestały zachodzić, bo nie ma już ciała stałego, które by się rozpuszczało? Wielu w pierwszej chwili powie, że tak. Ale to nie jest poprawna odpowiedź. Przyjrzyjmy się, że przecież otrzymany roztwór ma inną temperaturę. A to oznacza, że otoczenie zacznie przekazywać ciepło do chłodniejszego układu:
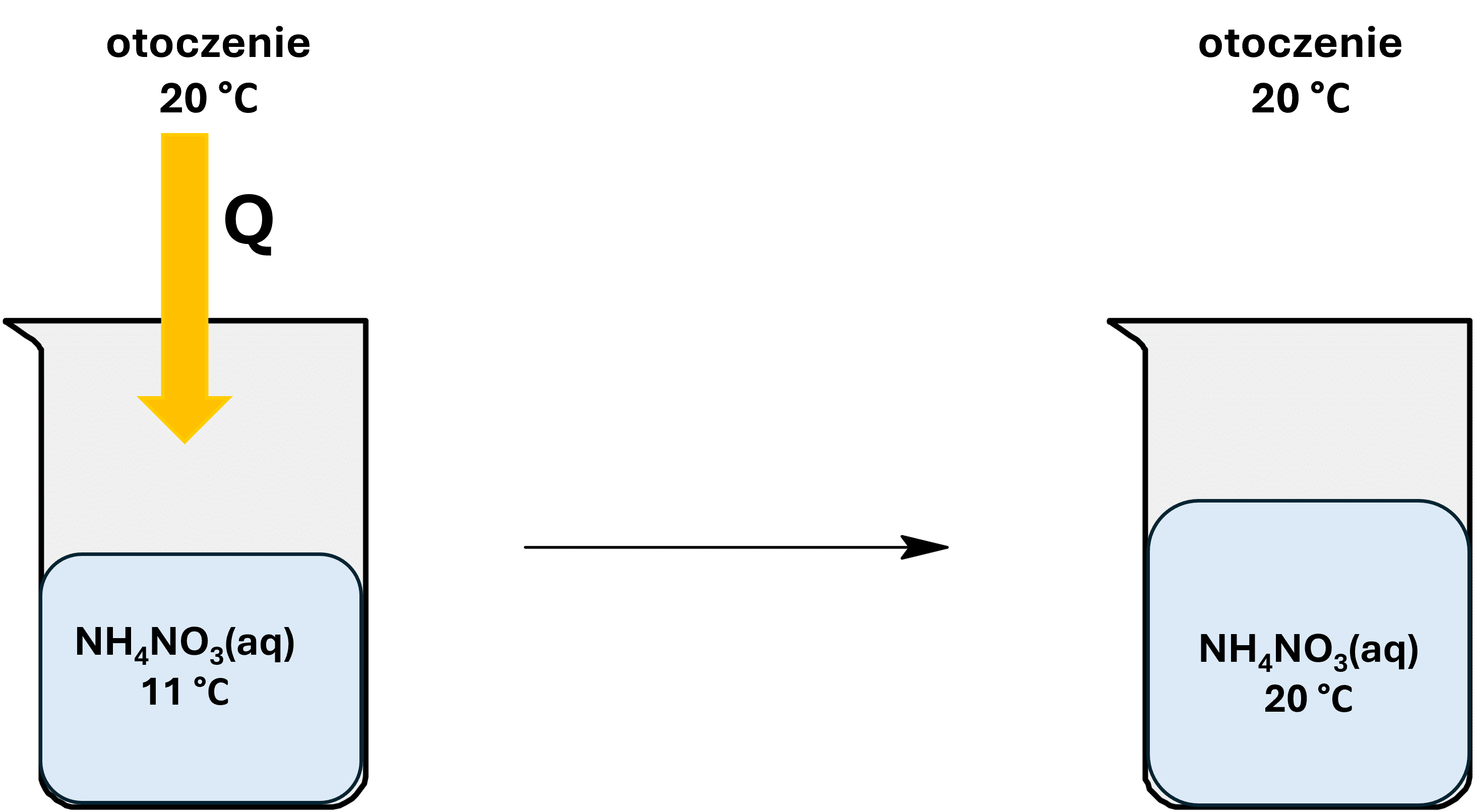
I dopiero gdy układ osiągnie temperaturę 20°C, przestaną zachodzić zmiany. Widzimy więc, że rozpuszczenie azotanu amonu nie jest równoznaczne z zakończeniem zmian w układzie. Zmiany kończą się dopiero wtedy, kiedy układ osiągnie temperaturę otoczenia.
Właśnie to ciepło przekazane pomiędzy układem a otoczeniem w celu wyrównania temperatur i zakończenia zmian nazywamy efektem energetycznym (tutaj jest to efekt cieplny). Rozpuszczanie więc NH4NO3 jest więc procesem endotermicznym.
Z kolei krystalizacja tej soli z roztworu wodnego jest procesem przeciwnym do rozpuszczania, Więc będzie to proces egzotermiczny: ze wzrostem temperatury układu, więc układ zacznie tracić ciepło. Tak samo spaliny mają znacznie wyższą temperaturę niż substraty i otoczenie, więc oddają ciepło do otoczenia. Czyli stygną. Spalanie np. węgla drzewnego to reakcja egzotermiczna.
Ilość energii w układzie nie zmienia się w magiczny sposób, a jedynie na drodze wymiany pomiędzy układem a otoczeniem. Ale w „magiczny” sposób podczas przemiany zmienia się temperatura układu. Początkowo produkty przemiany mają tę samą energię, która była zawarta w substratach tej przemiany. Ale uwaga, bo przy tej samej energii produkty mają już inną temperaturę. A skoro tak, to pojawia się różnica temperatur pomiędzy układem a otoczeniem, to równocześnie wymusza to przepływ ciepła i zmianę energii układu. Jeśli są osoby zainteresowane skąd ta zmiana temperatury, to niżej tłumaczę ten fakt.
A teraz jesteście już gotowi na to, by zmierzyć się z tym zadaniem. Odpowiedź jest podana tutaj - czy umiecie już wyjaśnić, dlaczego tak należy odpowiedzieć?
Efekty energetyczne tłumacze także w II części swojej książki „Podstawy obliczeń chemicznych”.
https://powtorkazchemii.pl/sklep/
Dla zainteresowanych:
Mieszamy wodę z NH4NO3, który się rozpuszcza. Ale ilość energii w układzie nie zmieni się w jakiś magiczny sposób. Jeśli początkowo NH4NO3 i woda miały 20 °C i zawierały łącznie w sobie 200 kJ energii, to po zmieszaniu i rozpuszczeniu układ też przecież musi mieć tych 200 kJ energii. W magiczny sposób się ona nie zmieni - musi być przekazana do otoczenia albo pobrana od otoczenia, jeśli ma się zmienić. Ok, więc roztwór też ma 200 kJ energii, bo musi mieć taką - nie wymienił nic z otoczeniem jeszcze.
Teraz musimy pomocniczo wprowadzić jeszcze jedno pojęcie: pojemność cieplna: substancje chemiczne i ich mieszaniny różnią się pojemnością cieplną. Pojemność cieplna mówi nam o tym, ile ciepła należy dostarczyć porcji naszej substancji (zwykle podawana jest dla 1 mola lub 1 kg tej substancji), aby zmienić jej temperaturę o 1 K (1 °C).
W skrócie: jeśli mam w osobnych naczyniach nasze porcje NH4NO3 i wody o temperaturze 0 K (-273,15 °C), to nie zawierają one ciepła. Żeby je ogrzać od tego zera bezwzględnego do 20 °C (293,15 K) to trzeba im łącznie dostarczyć 200 kJ ciepła. Ale tak to działa, gdy są to osobne porcje, np. każdy składnik w innym naczyniu. Jak je umieścimy razem w jednym, to powstaje roztwór, a on ma inną pojemność cieplną niż miały substraty w osobnych fazach. Jeśli więc mamy je umieszczone razem w jednym naczyniu i startujemy od 0 K, to jak im dostarczę tych 200 kJ ciepła, to taki układ się ogrzeje, ale uwaga: nie do 20 °C, tylko do 11 °C. Bo podczas ogrzewania powstaje roztwór NH4NO3, a on ma inną pojemność cieplną niż miały oba składniki w osobnych fazach. Roztwór ma większą pojemność cieplną, więc aby go doprowadzić do tej samej temperatury to trzeba mu dostarczyć więcej ciepła. Bo jest pojemniejszy cieplnie. Stąd aby taki układ ogrzać do 20 °C to trzeba dostarczyć łącznie więcej ciepła niż tych 200 kJ. Aby go ogrzać z tych 11 °C do 20 °C trzeba dostarczyć jeszcze dodatkowo np. 5 kJ ciepła. W skrócie: jak NH4NO3 i woda są osobno to potrzebuję 200 kJ ciepła dostarczyć z zewnątrz, by je ogrzać do 20 °C. Ale jak są razem to potrzebuję dostarczyć więcej, np. 200 + 5 kJ. No dobrze, bierzemy sobie NH4NO3 i wodę co mają 20 °C i mieszamy, rozpuszczamy. Substraty miały razem 200 kJ ciepła - roztwór też ma 200 kJ, ale ma inną pojemność cieplną. MA WIĘC INNĄ TEMPERATURĘ NIŻ SUBSTRATY. No dobrze, substraty i otoczenie miały 20 °C, roztwór ma 11 °C - to w którą stronę popłynie ciepło? DO UKŁADU. Otoczenie będzie przekazywać ciepło do układu tak długo, aż układ powróci do 20 °C. Otoczenie przekaże w tym celu 5 kJ ciepła. I tych 5 kJ to jest efekt energetyczny. Ostatecznie roztwór ma 205 kJ ciepła i temperaturę 20 °C. Efektem energetycznym przemiany jest tych 5 kJ pobranych od otoczenia.