Od wczorajszego przedwczoraj, to jest od 26 października 2023 docierają do mnie informacje, że anion siarczkowy nie istnieje. Najpierw były to serwisy angielskie, a wczoraj i dzisiaj dołączyły do nich polskie. Nie byłoby w tym nic dziwnego, gdyby nie fakt, że serwisy podjęły nagle temat sprzed ponad 5,5 roku. No prawie sześciu, bo wyniki badań zostały opublikowane 30.01.2018. Post na ten temat napisałem 03.06.2018 – celowo czekałem z nim aż będzie po maturze, aby uniknąć pewnych pytań no i obaw maturzystów. Jakoś nie przypominam sobie, by poza postem na naszym fanpage'u inne serwisy jakoś szerzej podjęły temat. Aż do wczorajszego przedwczoraj… Jeden z krajowych portali głosi wprost, że anion siarczkowy nie istnieje. Wszystkie podają też te samą informacje w tle, co sugeruje, że po prostu reszta skopiowała treści z innego portalu.
Przejdźmy jednak do rzeczy: o co chodzi z tym anionem siarczkowym? Przede wszystkim nagłówki nie wyjaśniają wszystkiego, a jeden z nagłówków pewnego krajowego czasopisma sugeruje wręcz, że takie związki jak siarczek sodu czy siarczek potasu, albo i siarczek ołowiu czy żelaza - nie powinny istnieć.

Nie. Wspomniany siarczek sodu (Na2S) istnieje i ma się dobrze. Co więcej, to o budowie krystalicznej wspomnianego siarczku sodu wiadomo, że jest odwrotnością struktury fluorku wapnia: w strukturze krystalicznej siarczku sodu miejsce kationów w krysztale fluorku wapnia zajmują aniony siarczkowe, a w miejsce anionów fluorkowych obecne są kationy sodu. Wynika to z faktu, że anion siarczkowy jest bardziej zbliżonych rozmiarów do kationów wapnia, a kation sodowy do anionu flourkowego.
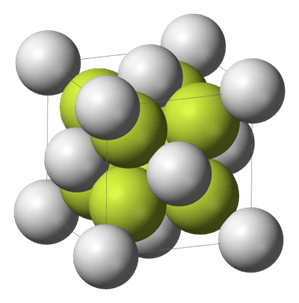
Bo siarczek sodu jest związkiem jonowym. Ma typową dla jonowych związków wysoką temperaturę topnienia: 1176 °C. Wynika z tego, że anion siarczkowy jednak istnieje. Tytuł o jego nieistnieniu, serwowany przez jeden z polskich serwisów popularyzujących naukę(?) jest na wyrost. Wszystkie ostatnie newsy odwołują się do tej publikacji z początku 2018 roku. Spójrzmy na jej tytuł:

Cytowany przeze mnie news na stronie Royal Society of Chemistry także zawiera taką uwagę:
A tego w żadnym wspomnianym newsie nie było. O, cóż więc chodzi? O to, co się dzieje w roztworze na przykład siarczku sodu w wodzie. Zacznijmy od siarkowodoru. Rozpuszczony w wodzie tworzy kwas siarkowodorowy, zwany też wodą siarkowodorową. W tablicach znajdujemy jego stałe dysocjacji: Ka1 i Ka2. Pierwszy etap dysocjacji:
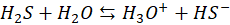
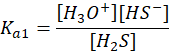
Oraz drugi etap dysocjacji:
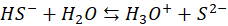
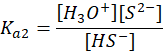
A ponieważ to kwas słaby, to spodziewamy się, że w roztworach siarczków w wodzie, np. takim Na2S dochodzi do dysocjacji zasadowej anionów siarczkowych (hydrolizy anionowej):
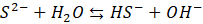
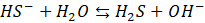
I tutaj także moglibyśmy zapisać odpowiednie stałe równowagi: Kb1 i Kb2. Z powodu dość daleko posuniętej hydrolizy wodne roztwory siarczku sodu czy siarczku potasu po prostu śmierdzą.
No właśnie oczekujemy tego, bo wszystkich tak uczono. Jeśli przejrzeć tablicę fizykochemiczne, to nie ma specjalnego problemu. Jeżeli chodzi o jeden wartość stałej dysocjacji H2S w wodzie. Tablica są w miarę zgodne. Ale problem pojawia się, gdy spróbujemy określić drugą stałą dysocjacji. Tutaj okazuje się, że wartości mieszczą się w przedziale pomiędzy 10-12,9 do 10-20. To jest rozstrzał o jakieś 100 milionów razy! Czyli jak od 1 grama do 100 ton! A przecież to ma znaczenie czy ja mam 1 g złota czy 100 t złota…
I tutaj dochodzimy do sedna. Autorzy pracy, na którą powołują się wspomniane newsy, rzeczywiście zainteresowali się sprawą przy okazji obliczeń związanych z ograniczeniem emisji rtęci w procesie rafinacji glinu. Bo to jednak różnica czy tej rtęci emitowanych do środowiska są gramy w skali roku, czy tony… Bo zależnie od tego, której wartości drugiej stałej dysocjacji używali w obliczeniach, wyniki były zupełnie różne. Przy okazji przyjrzeli się po prostu z prawie naukowo. Podeszli do problemu tak, jak naukowcy powinni pracować, czyli zajmować się nauką, a nie projektami. Co prawda zrobili to przy okazji, ale zajęli się nauką. Czystą nauką. Jakże tego nam teraz brakuje!
Przyjrzeli się więc starszym pracom i wynikom otrzymanym Przez wcześniejszych badaczy tego procesu. Okazuje się, że różni badacze stosowali różne techniki analityczne interpretowali błędnie otrzymane przez siebie wyniki. Zależnie od techniki wynik był więc całkowicie różny. Od Sasa do Lasa. Skupiano się na równowadze reakcji:
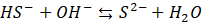
Wszyscy też pracowali ze stężonymi zasadami, podczas gdy tablicowe wartości stałych dysocjacji są podawane dla rozcieńczonych wodnych roztworów. Po prostu estymowali otrzymane wyniki do roztworów mocno rozcieńczonych. W skrajnym przypadku estymowano dane z roztworu NaOH o stężeniu 23 mol/dm3! To tak, jakbyśmy stwierdzili, że kwas siarkowy(VI) po rozcieńczeniu w wodzie ma takie same właściwości jak kwas stężony. Tylko reaguje na przykład wolniej, ale tak samo jak stężony reaguje z metalami z wydzieleniem SO2…
Uwzględniając to, co przez kilkadziesiąt lat błędnie interpretowano jako sygnały anionów siarczkowych - okazuje się, że w wodnych roztworach anion taki nie występuje, co zostało potwierdzone nowszymi obserwacjami techniką spektroskopii ramanowskiej. Dlaczego więc wszyscy się pomylili? Dlatego, że wszyscy podeszli do tego, zakładając z góry, że siarkowodór rozpuszczony w wodzie tworzy kwas dwuprotonowy. Prawdopodobnie niektórzy jako sygnał anionów siarczkowych uważali sygnał par jonowych. Ale autorzy pewnej pracy z 1983 roku również poddali w wątpliwość istnienie tego jonu w roztworach wodnych.
To się ciągle nie wyklucza z tym, że ani on taki nie istnieje, tylko po prostu nie istnieje w pewnych warunkach – w roztworach wodnych. Oznacza to, że kwas siarkowodorowy jest w istocie jednoprotonowy. A pierwszy etap hydrolizy w roztworach siarczków zachodzi nieodwracalnie:
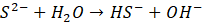
Wracając do spraw bardziej przyziemnych - z wodnych roztworów można otrzymać siarczek sodu lub siarczek potasu w postaci hydratów: Na2S*9H2O, K2S*2H2O, K2S*5H2O – czy to oznacza, że te wzory są błędne, bo jest tam woda? Zauważmy, że pierwszy wzór jest identyczny z izometrycznym NaHS*NaOH*8H2O. Ale niekoniecznie tak jest, że Na2S*9H2O to wzór niepoprawny. Co ciekawe, to w obecności nadmiaru NaOH podczas przepuszczania gazowego H2S przez roztwór NaOH można otrzymać kryształy będące hydroksosolą o prawdopodobnym wzorze: Na2S*NaOH*xH2O. Nawet nadtlenki metali krystalizują z wody! I… tworzą hydraty. Nadtlenek baru wypada z roztworu wodnego jako BaO2*8H2O… Tak, anion nadtlenkowy, który w wodzie nie istnieje, ale istnieje w równowadze z wodnym roztworem… I krystalizuje jako hydrat!
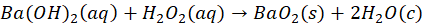
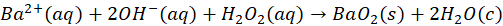
Otrzymywanie nadtlenku baru z wodnego roztworu można zobaczyć na tym filmie:
Czyli da się... Ponadto, gdyby na końcu zalkalizować roztwór - to ponownie wytrąci się BaO2. Wystarczy w tym celu woda amoniakalna. Żeby więc otrzymać hydrat nadtlenku baru nie trzeba użyć akurat wodorotlenku baru - wystarczy roztwór soli baru, jak BaCl2 czy Ba(NO3)2, perhydrol i woda amoniakalna. Po dodaniu perhydrolu do roztworu soli - nic się nie dzieje. Ale gdy dodamy tam wody amoniakalnej, to natychmiast strąca się biały osad BaO2*8H2O.
Trzeba tu bowiem odróżniać to, co się dzieje w sieci krystalicznej, od tego, co się dzieje w roztworze. Ot, wpuszczając FeCl3 do wody mamy strącenie osadu hydroksosoli ze względu na hydrolizę kationową w tym roztworze. A jednak związek ten krystalizuje z wody jako hydrat FeCl3*6H2O… Bo ta woda krystalizacyjna, a właściwie związana koordynacyjnie z kationem żelaza, stanowi naturalną otoczkę solwatacyjną. Dopiero w roztworze wodnym dochodzi do różnych zjawisk wtórnych. Kiedyś zresztą pożyczając chlorek żelaza(III) pewnemu naukowcowi mówiłem, że jak go będzie rozpuszczał w czystej wodzie, to będzie miał trochę osadu, bo hydrolizuje. „Jak może hydrolizować, skoro tworzy hydrat?” No właśnie tak. A pożyczanym chlorkiem był właśnie wspomniany hydrat.
W roztworach wodnych nie istnieją także aniony tlenkowe. Czy to oznacza, że nie ma tlenków istniejących w równowadze z wodą? Owszem, jeśli patrzymy na tlenki litowców, to powiemy, że nie, bo reagują one z wodą dając wodorotlenki. A to, że w roztworze wodnym nie istnieje anion tlenkowy - nie oznacza, że nie istnieje anion tlenkowy. Ot, tlenki litowców są jonowe.
Bardzo ciekawy przykład stanowi równowaga między tlenkiem, a wodą. Jeśli wpuścimy do wody tlenek wapnia albo tlenek magnezu, to w sposób nieodwracalny przejdą one w wodorotlenki. Ponieważ wodorotlenki wapnia i magnezu cechują się małą rozpuszczalnością w wodzie, to na dnie naczynia zbierze się osad wodorotlenku, a ciecz nad osadem będzie mieć odczyn zasadowy, bo będzie zawierać pewną ilość rozpuszczonego wodorotlenku.
To teraz zagadka! A co, gdy do wody wpuścimy np. tlenek cynku? Uczymy się, że takie tlenki nie reagują z wodą. I rzeczywiście osad tlenku cynku pozostanie tlenkiem cynku. Ale jeśli sprawdzimy pH fazy wodnej nad tym osadem tlenku, to okazuje się, że odczyn jest zasadowy! Na tyle zasadowy, że można to wykryć fenoloftaleiną!
A jeszcze bardziej zasadowy będzie w przypadku tlenku srebra. Wodorotlenek srebra jest bardzo nietrwały i zasadniczo zasady strącają tlenek srebra zamiast wodorotlenku srebra:
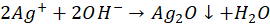
Ale dość pokaźnie zasadowy odczyn fazy wodnej nad tlenkiem srebra potwierdza, że osad ten jest w równowadze z roztworem, w którym są jony OH-.
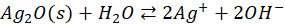
Także w przypadku Cu(OH)2 właściwa równowaga ustala się pomiędzy roztworem, a osadem tlenku, a nie wodorotlenku! A wynika to stąd, że wodorotlenek miedzi(II) także jest nietrwały i rozkłada się nawet w temperaturze pokojowej. Nasz niebieski galaretowaty osad po kilku godzinach w temperaturze pokojowej potrafi być czarnym osadem CuO na dnie. I analogicznie:
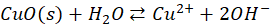
Co więcej, to nawet iloczyny rozpuszczalności w takich przypadkach dotyczą tej równowagi z tlenkiem, a nie z wodorotlenkiem! Bo to nie wodorotlenek istnieje w stanie równowagi z roztworem.
Co więcej - to czy próbowaliśmy kiedyś strącić Cu(OH)2 na gorąco? Przecież osady strącane na gorąco lepiej się dają odsączyć. No to spróbujmy podgrzać roztwór CuSO4 i roztwór NaOH i zmieszać... I nie ma niebieskiego osadu! Zamiast niego od razu wytrąca się czarny tlenek miedzi(II) CuO! Po prostu na gorąco Cu(OH)2 rozkłada się tak szybko, że nie obserwujemy jego wytrącenia nawet! Bo choć anion tlenkowy nie istnieje istnieje w wodzie, to jednak jakoś ten tlenek się musiał strącić. Rozkład anionów OH- na O2- i wodę, np:
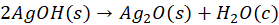
Anionów OOH- na OO2- i H2O2:
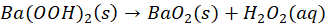
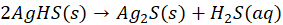
może zachodzić, i prawdopodobnie zachodzi: w ciele stałym, czyli osadzie - jak zapisałem w powyższych równaniach. Tak jak to nawet można zaobserwować przy strącaniu Ag2O, gdzie widać jak osad szybko zmienia wygląd.
Podsumowując: to, że w ciałach krystalicznych istnieje jon S2- a w roztworach wodnych wyłącznie HS- nie jest jakąś abstrakcją. Bo to zachowanie analogiczne do związków tlenu!
I analogicznie do tej równowagi:
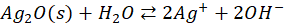
Możemy zapisać:
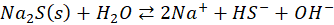
A nawet:
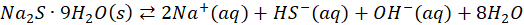
No bo kto nam zabroni? Te dwa przypadki różnią się tylko rozpuszczalnością w wodzie: jeden nieznacznie, drugi bardzo dobrze.
Ten artykuł oczywiście skończy się pytaniami: „A co pisać na maturze?”, „A jak podejść do zadań, w których każą policzyć stężenie anionów siarczkowych?” - są 2 opcje. Albo olać i napisać, że taki on nie istnieje w podanych warunkach, albo po prostu liczyć to o co poproszą. Sam zresztą byłem proszony o pomoc w policzeniu takiego zadania pewien czas temu. Osobiście uważam, że takie zadania nie powinny się ukazywać. I powinny zostać w te pędy wycofane. Cóż, uczniowie są karani zerem punktów za błędne założenie przy rozwiązywaniu zadań – autorów zadań też powinno to dotyczyć: zero punktów za ułożenie zadania opartego o błędne założenie.
Czy chemia wymaga poprawki? Tak, i to niejednej. Niestety. Ale też nie każda wiadomość o tym, że trzeba poprawić podręczniki powinna być przyjmowana w takij wersji, w jakiej ją przekazuje część serwisów.
W nowej karcie wzorów i stałych CKE pojawia się wartosć Ka2 dla H2S równa 10-19...
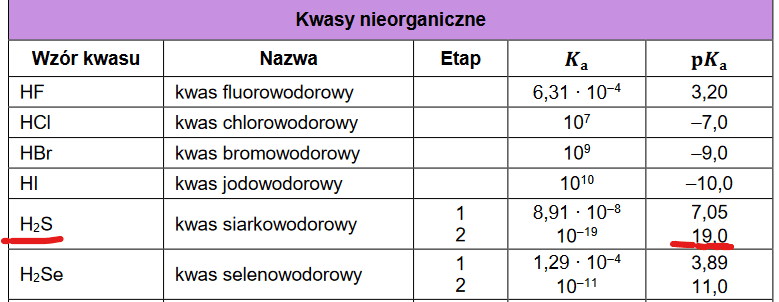

A w jeszcze innym zadaniu widziałem wartość 10-12,9... A sam pamiętam zadanie ze studiów, w którym przyjmowaliśmy 10-12…
Zdaniem niektórych te ostatnie newsy to odgrzewanie kotleta. Ale z własnego doświadczenia wiem, że odgrzewanie kotleta jest bardzo potrzebne. Tylko należy robić to tak, żeby odkłamując naukę nie zakłamać jej w inny sposób.
I tak jak często słyszę: "tlenków nie dysocjujemy" - co oczywiście odnosi się do wodnych roztworów, w których aniony tlenkowe nie istnieją, tylko z nią reagują przechodząc w wodorotlenki, np:
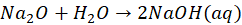
To może doczekamy się, że będziemy mówić: "tlenków i siarczków nie dysocjujemy".
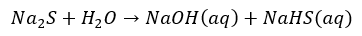
PPS w 2018 roku także byli tacy, którzy mówili, że anion siarczkowy nie istnieje.