Już starożytni Grecy i Rzymianie znali minerał (łac. minerare – wydobywać z ziemi), który występował m.i. na zboczach Wezuwiusza i którego używali przeciwko poceniu się. Minerał ten był przez tych pierwszych, a potem i drugich zwany alum, co nawiązywało do jego cierpkiego smaku. Dziś ten sam minerał w języku polskim zwiemy ałunem. Wiemy też, że jest uwodnioną solą podwójną: dwunastowodnym siarczanem glinowo-potasowym KAl(SO4)2·12H2O, a łaciński odpowiednik nazwy stał się prawdopodobnie podstawą do nazwania nowoodkrytego przez Davy’ego pierwiastka nazwanego po łacinie aluminium, a po polsku glinem. Ciężko stwierdzić, kiedy ludzkość zastosowała ałun po raz pierwszy, ale prawdopodobnie używano go w Egipcie jeszcze przed budową wielkich piramid w Gizie. Do czego był używany w starożytności? M. i. jako antyperspirant – do tego odniosę się na końcu.
Ogólnie ałunami zwiemy nie tylko znany od starożytności siarczan glinowo-potasowy, ale każdą sól podwójną o budowie analogicznej do tej soli: MIMIII(SO4)2·12H2O, gdzie przez MI rozumiemy kation jednododatni (np. K+, NH4+), MIII kation trójdodatni (jak Al3+, Fe3+, Cr3+ itd.). Celowo podałem taki zestaw kationów, bo wchodzą w skład czterech najbardziej znanych ałunów. Najbardziej dostępny jest oczywiście występujący w naturze ałun glinowo-potasowy, ale ałuny są znane chyba każdemu, kto eksperymentował z barwnymi kryształami. Bardzo popularny jest ciemnofioletowy siarczan chromowo-potasowy KCr(SO4)2·12H2O (fot) oraz jego amonowy odpowiednik o podobnej barwie NH4Cr(SO4)2·12H2O.

Ale nic tak nie działa na wyobraźnię, jak duże monokryształy! Te w przypadku ałunów otrzymać bardzo łatwo!

Kolejnym ałunem jest siarczan żelaza(III) i amonu NH4Fe(SO4)2·12H2O o barwie jasnoametystowej, czyli jasnofioletowej. Są to wręcz klasyki, bo związki te mają dość szczególną cechę, o której za chwilę. Oczywiście potencjalnie ałunów jest wiele, jednakże nie wszystkie kationy jednododatnie mają odpowiednią wielkość – np. kation litowy są zbyt mały, by się wbudować w sieć krystaliczną razem z kationem trójdodatnim, a w przypadku sodu są znane niektóre połączenia tego typu. Z kationów trójdodatnich to warto jeszcze wspomnieć o takich kationach, jak Mn3+ oraz Co3+ czy Ga3+. Choć kolorystyka ałunów jest bogata (np. CsMn(SO4)2·12H2O jest koralowoczerwony, a KCo(SO4)2·12H2O ciemnoniebieski), to jednak w domowym zaciszu nie przyjdzie nam podziwiać wszystkich. Część z nich jest nietrwała ze względu na duże skłonności do hydrolizy w wodnym roztworze i może być otrzymana tylko w rozcieńczonym kwasie siarkowym, gdzie należą ałuny tworzone z kationem Mn3+, lub też trójdodatni jon może być tak silnym utleniaczem, że w kontakcie z wodą utlenia wodę z wydzieleniem tlenu, a sam się redukuje do dwudodatoniego. Tak jest w przypadku Co3+. Pozostaje więc pogodzić się z losem. Lecz nie wszystko stracone! Ba! Nagroda pocieszenia może być ciekawsza niż nagroda główna!
Przejdźmy jednak do rzeczy. Znakomita postać, którą był śp. Stefan Sękowski (zmarły w 2014 roku), w książeczce „Bazar chemiczny” wspomina o ałunie glinowo-potasowym, chromowo-potasowym i tajemniczym zielonym ałunie żelazawo-amonowym o wzorze sumarycznym (NH4)2Fe(SO4)2·6H2O (choć przez pomyłkę w książeczce wpisane jest 12H2O). I choć autor nazywa tę sól ałunem żalazawo-amonowym, to jednak nie jest to ałun, tylko pospolita sól Mohra: siarczan(VI) żelaza(II) diamonu, która jest przedstawicielem innego typu soli podwójnych: soli Tuttona.

Sole Tuttona (zwane też schoenitami) tym się różnią od ałunów, że są kombinacją kationu dwudodatniego i dwóch jednododatnich, oraz zawierają mniej wody: M2IMII(SO4)2·6H2O. Pierwsza nazwa pochodzi od nazwiska dra Alfreda Edwina Harolda Tuttona, jednej z zasłużonych postaci dla krystalografii, dzięki któremu zawdzięczamy wydzielenie tej grupy soli. Z kolei druga nawiązuje do schoenitu – naturalnie występującego minerału K2Mg(SO4)2·6H2O, więc analogicznie do ałunów. Wspomniana sól Mohra to najbardziej znana przedstawicielka soli Tuttona. A rodzina ta jest bardzo liczna! I bardzo kolorowa. Nasza sól Mohra ma swoich braci starszych w wierze, jak czerwony (NH4)2Co(SO4)2·6H2O (fot. 2) ciemnozielony (NH4)2Ni(SO4)2·6H2O, oraz młodszych, jak jasnoróżowy (NH4)2MnII(SO4)2·6H2O, niebieski (NH4)2CrII(SO4)2·6H2O.

Zarówno w ałunach jak i solach Tuttona kationy o wyższym ładunku nie występują jako kationy proste, tylko jako tzw. akwakompleksy: [M(H2O)6]n+, gdzie n wynosi 2 lub 3. Poniżej widzimy strukturę krystaliczną siarczanu(VI) amonu żelaza(II), czyli soli Mohra:
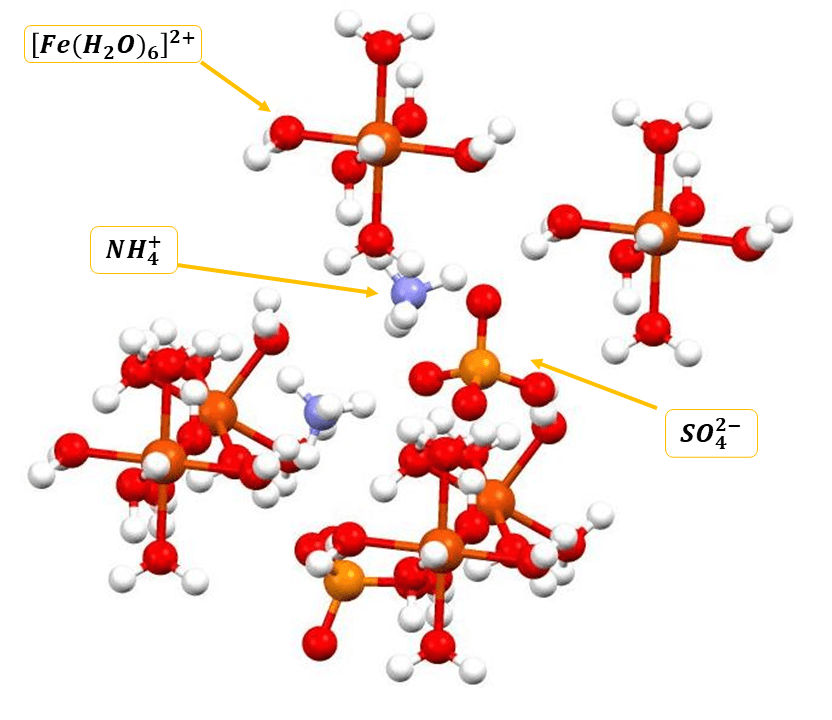
Co ciekawe, to wiele pierwiastków znajdziemy zarówno w ałunach, jak i solach Tuttona: wystarczy, że dany pierwiastek tworzy zarówno kationy dwudodatnie jak i trójdodatnie. Stąd np. żelazo znajdziemy w jasnozielonej soli Mohra i jasnoametystowym ałunie żelazowo-amonowym. Szczególnym przypadkiem jest tal – metal ten występuje tworząc zarówno kationy Tl+, jak i Tl3+, a więc może pełnić w ałunach podwójną rolę, zależnie od stopnia utlenienia. A na dodatek Tl+ występuje zarówno w ałunach, jak i w solach Tuttona. W naturze jest obecny w jednym z ałunów TlAl(SO4)2·12H2O jako minerał lanmuchangit.
Kolejnym ciekawym przypadkiem są zasady azotowe. Wiemy, że amoniak łatwo tworzy jednododatni kation amonowy, ale w ałunach i solach Tuttona znajdziemy też kationy tworzone przez aminy organiczne, jak i przedstawicielkę amin nieorganicznych: hydroksyloaminę NH2OH. W przypadku etylenodiaminy H2NCH2CH2NH2 mamy dwa atomy azotu połączone dwuwęglowym łańcuchem. Każdy z obu atomów azotu może utworzyć kation amoniowy i jedna cząsteczka etylenodiaminy pełni rolę dwóch pojedynczych kationów jednododatnich w solach Tuttona. Z kolei hydrazyna H2N-NH2 z racji zdolności do tworzenia kationu jednododatniego H2N-NH3+ jak i dwudodatniego H3N+-NH3+ potencjalnie może występować zarówno w ałunach, jak i solach Tuttona, np. w (N2H5)2Co(SO4)2·6H2O.
A co z anionami? Selen jest analogiem siarki w układzie okresowym. Zarówno jon siarczanowy(VI) SO42- jak i selenianowy(VI) SeO42- mają budowę tetraedryczną. Liczne seleniany przypominają właściwościami siarczany, łącznie z układami krystalicznymi – czy więc możliwe jest utworzenie selenowych odpowiedników ałunów lub soli Tuttona? Okazuje się, że tak. Sole podwójne będące analogami siarczanowych ałunów zwiemy ałunami selenowymi. Lecz to jeszcze nie wyczerpuje zasobów anionów tetraedrycznych, bowiem wydzielono także analogi zawierające takie aniony jak CrO42- czy BeF42-. Taka sytuacja!
I to jest właśnie piękne w połączeniach jonowych!
Zarówno ałuny jak i sole Tuttona bardzo chętnie tworzą hydraty, czyli są takim rodzajem solwatów, gdzie w sieci krystalicznej znajdują się cząsteczki rozpuszczalnika – w tym przypadku wody. Naturalnie występujące przy powierzchni Ziemi solwaty to zwykle hydraty i nasze siarczany nie są tutaj wyjątkiem – spotykane w naturze ałuny i sole Tuttona są hydratami. Jednakże zanim przejdziemy dalej, wyjaśnijmy sobie jeszcze, że hydratami powszechnie nazywa się też związki, które albo wcale nimi nie są, albo są nimi tylko częściowo. Wynika to stąd, że w prawdziwym hydracie cząsteczki wody wbudowują się w sieć krystaliczną i na tym ich rola się kończy. Wypełniają po prostu puste miejsca w sieci krysztalicznej. Tymczasem zarówno sole Tuttona jak i ałuny nie zawierają prostych jonów dwu- i trójdodatnich, tylko wspomniane wcześniej kompleksowe jony, stąd ogólny wzór soli Tuttona poprawniej zapiszemy jako M2I[MII(H2O)6](SO4)2, a ałunów jako MI[MIII(H2O)6](SO4)2·6H2O – czyli tylko ałuny są częściowymi hydratami. Często jednak nie rozróżnia się tego i wszystkie połączenia zawierające wodę traktuje jako hydraty. Ale otrzymano także takie „solwaty”, w których cząsteczki wody zastąpiono np. hydrazyną, przykładem takiego związku jest (N2H5)2Ni(SO4)2·3N2H4. Zauważmy, że hydrazyna ma budowę H2N-NH2, czyli jedna cząsteczka hydrazyny odpowiada dwom cząsteczkom wody w akwakompleksie, stąd w przypadku hydrazyny współczynnik stechiometryczny wynosi 3 zamiast 6. A dodatkowo w związku tym w roli kationu jednododatniego mamy kation hydrazyniowy! Taka sytuacja!
Przywykliśmy do tego, że roztwory soli niklu są zielone. Lecz uwaga! Taka sytuacja ma miejsce, gdy mówimy o roztworach zawierających kompleksowy kation [Ni(H2O)6]2+. Tymczasem gdy rolę wody przejmuje hydrazyna, to nasza sól Tuttona nie zawiera już akwakompleksu, tylko kompleksowy jon z hydrazyną jako ligandem, czyli [Ni(N2H4)3]2+. I teraz pytanie, skoro barwa soli zależy od tego, przez jakie ligandy prosty jon metalu został skoordynoowany przez ligandy, to jaki kolor ma (N2H5)2Ni(SO4)2·3N2H4? I tutaj czeka nas niespodzianka, bo taka sól ma kolor…. Różowy. Lubimy żyć przekonaniem o kolorach jonów wyniesionym ze szkoły, jednakże to dotyczy tylko wodnych układów. A gdybyśmy zamienili wodę na hydrazynę we wszystkich ałunach i solach Tuttona? Otrzymalibyśmy całkiem nową paletę barw tych związków i zupełnie inną od tej, do której przywykliśmy myśląc o konkretnym jonie, czyli odnosząc się do akwakompleksu.
Ałuny i sole Tuttona mają wspólną cechę – tworzą identyczne sieci krystaliczne – takie ciała zwiemy izomorficznymi. Na tym polega piękno związków jonowych! Bo ponadto mogą ze sobą współkrystalizować różne ałuny i różne sole Tuttona. Jony [Cr(H2O)6]3+ i [Al(H2O)6]3+ są podobne. Umieszczając kryształek jednego ałunu w przesyconym roztworze innego ałunu otrzymamy kryształ, którego jądro będzie stanowić pierwszy ałun, a powłokę inny ałun. Np. zaczynając krystalizację od fioletowego ałunu chromowo-potasowego, otrzymamy ciemnofioletowy kryształ. Jeśli go potem przeniesiemy do roztworu bezbarwnego ałunu glinowo-potasowego, to na jego powierzchni zacznie narastać warstwa bezbarwna. Można oszukać kryształ i podmienić kationy jednego metalu na inne, ale podobne – układ „nie zauważy” zamiany – zachowa się tak samo, jakby go włożyć do tego samego roztworu, z którego został wyjęty. Czyli zacznie dalej rosnąć ten kryształ, tyle że nowa warstwa będzie mieć inny kolor… otrzymamy kryształ, którego jądro będzie fioletowe, a zewnętrzna warstwa bezbarwna. Można też tworzyć kryształy wielowarstwowe o różnych barwach przenoszą kryształ z roztworu do roztworu.
Czy musimy się ograniczać do soli podwójnych? Niekoniecznie, bo można wydzielić też sole potrójne! I to wcale nie jest trudne. Np. (NH4)16CoNi7(SO4)16·48H2O lub krócej (NH4)2Co0,17Ni0,83(SO4)2·6H2O. Po prostu część odpowiadających za zieloną kationów [Ni(H2O)6]2+ zastąpiły czerwone kationy [Co(H2O)6]2+. Okazuje się zatem, że możemy dobierać różne jony i tym samym wpływać na kolor kryształu! Można go w pewnym stopniu projektować. Jako że w przypadku wspomnianej soli potrójnej jest to kolor ciemny kolor zgniłozielony (a jest to rzadko spotykany kolor), to kryształy te mogą stanowić oryginalny eksponat w domowej kolekcji kryształów.

I tak jak przenosząc kryształek z roztworu do roztworu możemy nabudowywać kolejne warstwy o różnych kolorach, tak możemy otrzymać kryształ o jednej barwie, ale dość oryginalnej.
Wszyscy kojarzymy niebieskie kryształy CuSO4·5H2O, prawda? Piszę wszyscy, bo czytelnikami są zapewne osoby mające coś z chemią wspólnego. Duże kryształy są ciemnoniebieskie, wręcz szafirowe:
Gdyby rozpuścić w wodzie CuSO4·5H2O i pozostawić do odparowania, to otrzymamy z powrotem kryształy o składzie: CuSO4·5H2O. Ale jeśli rozpuścić w wodzie zarówno CuSO4·5H2O jak i (NH4)2SO4 w stosunku molowym 1 : 1 i pozostawić do odparowania wody, to nie pojawią się ani kryształy CuSO4·5H2O, nie pojawią się bezbarwne kryształy (NH4)2SO4, ale pojawią się kryształy o mniej intensywnej barwie i o składzie (NH4)2Cu(SO4)2·6H2O – sól Tuttona. Analogicznie będzie z jasnoróżowymi kryształami MnSO4·H2O.

A co jeśli rozpuścimy w wodzie MnSO4·H2O, CoSO4·6H2O i (NH4)2SO4 w stosunku molowym 1 : 1 : 2? Tak jak w przypadku ałunów można oszukać system przenosząc kryształki z roztworu do roztworu, tak i w przypadku wymieszania roztworów oszukamy system. Jony miedzi i manganu jako że są jonami tego samego typu, mogą się zamiennie wbudowywać w tę samą sieć krystaliczną. Czyli otrzymamy kryształ, który oprócz jonów amonowych będzie zawierał Kationy 2 metali: Mn2+ i Co2+. Intensywna czerwona barwa (NH4)2Co(SO4)2·6H2O zostanie rozjaśniona przez prawie bezbarwne kationy manganu, a kryształy mogą mieć skład taki: (NH4)2Co0,5Mn0,5(SO4)2·6H2O.

Od lewej: (NH4)2Mn(SO4)2·6H2O, (NH4)2Co0,5Mn0,5(SO4)2·6H2O, (NH4)2Co(SO4)2·6H2O
Analogicznie możemy rozjaśnić barwę NH4)2Cu(SO4)2·6H2O:

Kryształ o prawdopodobnym składzie (NH4)2Cu0,5Mn0,5(SO4)2·6H2O
MnSO4 to bardzo fajny rozjaśniacz kryształów w przypadku soli Tuttona. I wcale nie trzeba się ograniczać do nich! Z ałunami też się da. Można sobie otrzymać taki syntetyczny „ametyst” – bo kolor dość podobny. Ten kryształ powstał przez rozpuszczenie dwóch ałunów w wodzie, tj. KCr(SO4)2·12H2O, KAl(SO4)2·12H2O w stosunku molowy 1:3, co odpowiada prawdopodobnemu składowi KAl0,75Cr0,25(SO4)2·12H2O.

Al(SO4)2·18H2O lub KAl(SO4)2·12H2O to wygodne rozjaśniacze kryształów ałunów.
Podany skład soli potrójnych może się różnić od stosunku molowego jonów w roztworze – bo zapewne w takich przypadkach o szybkości wbudowywania się do sieci krystalicznej decyduje także kinetyka i efekty energetyczne – a te mogą być inne dla obu jonów i nawet jeśli w roztworze byłoby tyle samo jonów Al3+ i Cr3+ (jako akwakompleksy) – to znaczy, że będą się z różną szybkością wbudowywać i w sieci krystalicznej ich stosunek może odbiegać od 1 : 1. W przypadku kryształów (NH4)2Co0,17Ni0,83(SO4)2·6H2O stosunek molowy jonów kobaltu do niklu wynosi 1 : 7, podczas gdy w roztworze wynosił 1 : 3,33, czyli jony kobaltu wbudowują się mniej chętnie, niż kationy niklu.
Tak oto poznaliśmy niezwykłe bogactwo świata soli podwójnych, a nawet potrójnych! Niestety, szkolna edukacja często pomija ich fascynującą naturę ☹
Kryształy z własnych hodowli. Fotografie: Adam Rędzikowski.
PS na sam koniec chciałbym się odnieść do ałunu glinowego - występuje w naturze i starożytni stosowali jako antyperspirant. Od około dekady jest on reklamowany hasłem jako naturalny antyperspirant. Czasem nawet pod dodatkowym sloganem: nielaboratoryjny. Stosowanie zwiazków glinu w antyperspirantach jest kontrowersyjne - pamiętajmy o tym, gdy będziemy chcieć zamienić "te złe antyperspiranty" w sztyfcie na "dobry ałun" - bo choć występuje w naturze to jest to właśnie związek glinu w czystej postaci. Czyli z deszczu pod rynnę.
Bibliografia:
1. D. Nicholls: „The Chemistry of Iron, Cobalt and Nickel”; Pergamon Press, 1975
2. C. K. Patil, R. Soundararajan, V. R. Pai Veineker: „Preparation and characterization of hydrazine derivatives. Part-II : Reaction of transition metal ammonium double sulphates with hydrazine hydrate”; Proc. Indian Aead. Sci,, wol, 88 (1979) A, numer 3, str. 211-216,
3. G. Giester: „Crystal structure RbFe3+(SeO4)2”, Monatshefte fuer Chemie, wol. 125 (1994), str. 1223-1228,
4. A. J. Berry, B. D. Cole and R. S. Armstrong: „Raman Spectra of the a-Alums CsM(SeO4)2*12H2O (M= Ga, In)”, J. Raman Spectrosc. wol. 30 (1999), str.73-76,
5. V. M. Petrusevski: „The structures of dimethylammonium metal(Ill) sulfate hexahydrates (metal = AI, Cr)”; Acta Cryst (1994). Sekcja B, wol. 50, str. 625-627,
6. F. Bosi, G. Belardi, P. Ballirano: „Structural features in Tutton’s salts K2[M2+(H2O)6](SO4)2, with M2+ = Mg, Fe, Co, Ni, Cu, and Zn”; American Mineralogist, Volume 94 (2009), str. 74–82,
7. A. H. C. Ledsham, H. Steeple: „The Classification of the Chromium Alums”; Acta Cryst. (1969). Sekcja B, wol. 25, str. 398-400,
8. Genbo Su, Xinxin Zhuang, Youping He, Guozong Zheng: „A new crystal of ammonium cobalt nickel sulfate hexahydrate for UV light band-pass filter”; Optical Materials, wol. 30 (2008), str. 916–919